 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Обчислення. Приклад 5. Кисень масою 2 кг займає об’
|
Читайте также: |
 Дж;
Дж;
 Дж.
Дж.
Відповідь: ε об = 4,63·10-21 Дж; E об = 364 Дж.
Приклад 5. Кисень масою 2 кг займає об’єм 1 м3 і знаходиться під тиском 0,2 МПа. Газ було нагріто до об’єму 3 м3, а потім при сталому об’ємі до тиску 0,5 МПа. Знайти зміну внутрішньої енергії газу, виконану ним роботу і теплоту, передану газу. Побудувати графік процесу.
Дано: m = 2 кг;  32·10-3 кг/моль; V 1 = 1 м3; V 2 = V 3=3 м3; p 1 =
32·10-3 кг/моль; V 1 = 1 м3; V 2 = V 3=3 м3; p 1 =
p 2 = 2·105 Па; p 3 = 5·105 Па.
Знайти:  U; A; Q.
U; A; Q.
Розв’язок. З умови задачі випливає, що зміна термодинамічних параметрів системи відбувається у два етапи. Повну зміну внутрішньої енергії газу можна визначити з виразу:
 . (1)
Тут . (1)
Тут  – різниця температур у кінцевому і початковому станах, а i – ціле число, обумовлене кількістю ступенів вільності молекули. Для двоатомної молекули кисню за типових – різниця температур у кінцевому і початковому станах, а i – ціле число, обумовлене кількістю ступенів вільності молекули. Для двоатомної молекули кисню за типових
|  Рис. 2.1. Рис. 2.1.
|
умов i = 5, тому що в тепловому русі беруть участь 3 ступені свободи поступального руху і 2 ступені свободи обертального руху, а коливальний рух практично відсутній.
Початкову і кінцеву температуру газу можна знайти з рівняння Менделєєва-Клапейрона
 ; (2 а)
; (2 а)
 ; (2 б)
; (2 б)
 . (2 в)
. (2 в)
Відповідно до умови, на першому етапі газ одночасно розширюється і нагрівається, а на другому – тільки нагрівається. Робота розширення газу при постійному тиску (на першому етапі) виражається формулою
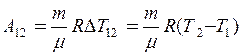 . (3)
. (3)
На другому етапі робота розширення дорівнює нулю, тому що
V 2 = V 3. Таким чином, повна робота, виконана газом, дорівнює роботі, здійсненої ним на першому етапі, тобто A 13 = A 12.
Теплота, що передана газу, відповідно до першого закону термодинаміки, дорівнює сумі змін внутрішньої енергії і роботи
Q =  U + A. (4)
U + A. (4)
Поиск по сайту: