 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Свойства и функции белков
Изучение нового материала проводится в два этапа.
На первом этапе в ходе беседы учитель объясняет все функции белков. Объясняется значение каталазы в растительной и животной клетке: ее присутствие во всех клетках растений и животных, ее функции — расщепление опасного для клетки пероксида водорода до кислорода и воды. На втором этапе проводится практическая работа по обнаружению каталитической функции каталазы и явления денатурации.
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки являются амфотерными соединениями, сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот. Чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков, один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые, есть нерастворимые белки, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки необычайно активные (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (изменение температуры, солевого состава среды, рН, радиация) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Причем первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Вместе с тем, денатурация не сопровождается разрушением полипептидной цепи. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Денатурация может быть: обратимой, если возможно восстановление свойственной белку структуры. Такой денатурации подвергаются, например, рецепторные белки мембраны, процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.. Обычно это происходит при разрыве большого количества связей, например, при варке яиц. Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом. Функции их разнообразны.
Одна из важнейших — строительная. Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран, шерсти, волос, сухожилий, стенок сосудов и т.д.
Транспортная. Некоторые белки способны присоединять различные вещества и переносить их к различным тканям и органам тела, из одного места клетки в другое. Например, белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно.
Регуляторная. Большая группа белков организма принимает участие в регуляции процессов обмена веществ. Такими белками являются гормоны — биологически активные вещества, выделяющиеся в кровь железами внутренней секреции (гормоны гипофиза, поджелудочной железы). Например, гормон инсулин регулирует уровень сахара в крови путем повышения проницаемости клеточных мембран для глюкозы, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Защитная. В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
Двигательная. Особые сократительные белки участвуют во всех видах движения клетки и организма: образовании псевдоподий, мерцании ресничек и биении жгутиков у простейших, сокращении мышц у многоклеточных животных, движении листьев у растений и др.
Весьма важна для жизни клетки сигнальная функция белков. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
Запасающая. Благодаря белкам в организме могут откладываться про запас некоторые вещества. Например, при распаде гемоглобина железо не выводится из организма, а сохраняется в организме, образуя комплекс с белком ферритином. К запасным белкам относятся белки яйца, белки молока.
Энергетическая. Белки являются одним из источников энергии в клетке. При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются тогда, когда другие (углеводы и жиры) израсходованы.
Каталитическая. Одна из важнейших функций белков. В состав клеток входит большое количество веществ, химически мало активных. Тем не менее, все биохимические реакции протекают с огромной скоростью, благодаря участию в них биокатализаторов — ферментов — веществ белковой природы. Скорость ферментативных реакций в десятки тысяч (а иногда и в миллионы раз) выше скорости реакций, идущих с участием неорганических катализаторов. Например, пероксид водорода без катализаторов разлагается медленно: 2Н202 → 2Н20 + 02. В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза за 1 сек. расщепляет до 100 тыс. молекул Н202.
Ферменты – глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр – небольшой участок фермента (от трех до двенадцати аминокислотных остатков), именно в котором происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
|
В 1959 году Д. Кошланд выдвинул гипотезу, по которой пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом (рис. 1). Эту гипотезу называют гипотезой "руки и перчатки" (гипотезой индуцированного соответствия).
Поскольку все ферменты являются белками, их активность наиболее высока при физиологически нормальных условиях: большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 5О°С) каталитическая активность растет (на каждые 10°С ско-
рость реакции повышается примерно в 2 раза). При температуре выше 50°С белок подвергается денатурации и активность фермента падает. Кроме того, для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность.
На скорость реакции влияет также концентрация субстрата и концентрация фермента. При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Закрепление. Работа учащихся с тетрадью и кодограммой. Выполнение практической работы и объяснение ее результатов.
Задание к практической работе.
1. Прилейте по 2мл Н2О2 (пероксида водорода) в пробирки с кусочком сырого мяса, с сырым и вареным картофелем. Объясните наблюдаемые вами явления при действии пероксида на живые и мертвые клетки (в пробирке с вареным картофелем).
2. На предметное стекло в каплю воды положите лист элодеи и рассмотрите под микроскопом на малом увеличении место отрыва листа от стебля.
3. Нанесите на лист элодеи две капли пероксида водорода, накройте покровным стеклом и под микроскопом рассмотрите место отрыва листа от стебля. Объясните бурное выделение пузырьков кислорода из поврежденных клеток листа элодеи.
Задание на дом. Изучить текст параграфа, ответить на вопросы.
Приложение 1. Кодограмма к уроку. Приложение 2. Карточка для работы у доски.
|
| ||||
Приложение 3. Тестовое задание.
Задание 3. "Строение белков"
Тест 1. В клетке на первом месте по массе из органических веществ:
1. Углеводы.
2. Белки.
3. Липиды.
4. Нуклеиновые кислоты.
**Тест 2. В состав простых белков входят:
1. Углерод. 5. Фосфор.
2. Водород. 6. Азот.
3. Кислород. 7. Железо.
4. Сера. 8. Хлор.
Тест 3. Все многообразие белков образуют:
1. 170 видов аминокислот.
2. 26 видов аминокислот.
3. 20 видов аминокислот.
4. 10 видов аминокислот.
Тест 4. Незаменимыми для человека являются:
1. 7 аминокислот.
2. 20 аминокислот.
3. 10 аминокислот.
4. Таких аминокислот нет.
Тест 5. Неполноценными считаются белки:
1. В которых отсутствуют некоторые аминокислоты.
2. В которых отсутствуют некоторые незаменимые аминокислоты.
3. В которых отсутствуют некоторые заменимые аминокислоты.
4. Все известные белки являются полноценными.
Тест 6. Функциональные группировки придают аминокислотам свойства:
1. Кислые — радикал, щелочные — аминогруппа.
2. Кислые — аминогруппа, щелочные — радикал.
3. Кислые — карбоксильная группа, — щелочные — радикал.
4. Кислые — карбоксильная группа, щелочные — аминогруппа.
Тест 7. Пептидная связь образуется в результате:
1. Реакции гидролиза.
2. Реакции гидратации.
3. Реакции конденсации.
4. Все выше перечисленные реакции могут привести к образованию пептидной связи.
Тест 8. Пептидная связь образуется:
1. Между карбоксильными группами соседних аминокислот.
2. Между аминогруппами соседних аминокислот.
3. Между аминогруппой одной аминокислоты и радикалом другой.
4. Между аминогруппой одной аминокислоты и карбоксильной группой другой.
Тест 9. Стабилизируют вторичную структуру белков:
1. Ковалентные связи.
2. Водородные связи.
3. Ионные связи.
4. Такие связи отсутствуют.
Тест 10. Молекула гемоглобина имеет структуру:
1. Первичную.
2. Вторичную.
3. Третичную.
4. Четвертичную.
Поиск по сайту:
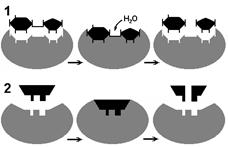 Рис. 1. Соответствие фермента и субстрата:
1 — гипотеза "ключа и замка"; 2 — гипотеза "руки и перчатки.
Рис. 1. Соответствие фермента и субстрата:
1 — гипотеза "ключа и замка"; 2 — гипотеза "руки и перчатки.
