 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Принцип запрета Паули
В большинстве интересных задач, к которым желательно было бы применить идеи микроскопической физики, фигурируют системы с большим количеством движущихся частиц, например атомы с многими электронами, потоки электронов в микроскопически маленьком объеме твердого тела и др. Можно было бы предположить, что если система содержит в себе не один, а много электронов, то следует рассматривать движение каждого электрона независимо от остальных, а для получения общего решения, похожего на уже когда-либо кем-либо найденное, необходимо просуммировать решения, полученные для отдельных электронов. Тогда энергия всего атома окажется суммой энергий электронов в их различных состояниях. Наинизшей энергией в этой модели обладал бы атом, в котором все электроны находились бы в наинизшем энергетическом состоянии.
Однако в квантовой механике действует совершенно иной и существенно новый принцип (не имеющий себе аналога в классической механике) и относящийся именно к случаю многоэлектронных атомов. Этот принцип - принцип запрета Паули - гласит, что в данный момент времени в определенном квантовом состоянии в атоме (а в общем случае в одной и той же области пространства, где действуют законы квантовой механики) может находиться лишь один электрон. Определенное квантовое состояние означает наличие частицы с конкретным набором квантовых чисел. Согласно основным положениям квантовой механики каждый отдельный электрон можно описать при помощи четырех квантoвыx чисел:
n=1,2,…;
l=0,1,…,n-1;
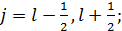 (1.5)
(1.5)
m=-j,-j+1,…,+j,
где п - главное квантовое число (оно может принимать все значения от 1 и более); l- азимутальное квантовое число, изменяющееся от О до n-1; j - внутреннее квантовое число, которое может принимать только два приведенных значения; т - проекция j на специально выбранное направление, по правилам пространственного квантования изменяющееся от -j до +j, пробегая при этом (2j + 1) значений.
Два электрона эквивалентны, если у них одинаковые п и одинаковые 1. Поэтому согласно принципу Паули два эквивалентных электрона должны отличаться друг от друга направлением либо спина, либо m.
Принцип Паули существенно усложняет рассмотрение энергетических состояний более сложных атомов или энергетических состояний электронов в кристаллах. Например, если атом имеет систему энергетических состояний, сходную со спектром атома кислорода, то на низшем энергетическом уровне могут располагаться только два электрона, поскольку этот уровень двухкратно вырожден. Третий электрон должен располагаться уже на следующем, более высоком, уровне. После того как и этот уровень заполнится, последующие электроны должны переходить на еще более высокие уровни. Развитие технологии наноэлектроники привело к тому, что, казалось бы, столь далекий от реальной жизни принцип Паули работает в таком сугубо прагматическом приборе, как атомно-силовой микроскоп, при помощи которого можно наблюдать за отдельными атомами.
Поиск по сайту: