 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Пути изменения внутренней энергии. Теплота и работа. Первое начало термодинамики. Работа расширяющегося газа
Пути изменения внутренней энергии ( 2 способа ): 1-ый сп-б – это подвод (отъем) теплоты Q. Подвод теплоты (теплообмен)- это сп-б изменения внутр. эн., связанный с хаотическим и тепловым движением микрочастиц, составляющих данную систему. 2-ой сп-б – рабочее действие (совершение работы А). Это такой процесс, связанный с упорядоченным перемещением в пространстве системы как целое. Работа – это упорядоченная форма передачи энергии от системы среде или наоборот. Теплота - неупорядоченная форма обмена энергией между системой и средой, т.к. она является результатом беспорядочного (теплового) движения микрочастиц вещества, но не самого тела как целого.. Первое начало термодинамики – изменение внутренней энергии системы, равно кол-ву подведенной теплоты(Q>0) за вычетом работты, которую совершила система над окр. средой (A>0). ∆U=Q-А (в интегральной форме) dU=ᵟQ-ᵟA (в дифференциальной форме) Очень важным видом работы является работа расширения (сжатия) газа – такая работа наз-ся объемной (связана с изменением V газа) ᵟA (объемн.) = P(внеш.)*dV: A>0- расширение газа, A<0- сжатие газа.
57. Теплоемкость идеального газа, зависимость от степеней свободы. Уравнение Майера Теплоёмкость идеального газа — отношение кол-ва теплоты, сообщённого газу, к изменению температуры δТ, которое при этом произошло. С=δQ/ dТ. С(уд)= δQ/m*dT- удельная теплоемкость – кол-во т-ты, кот. нужно сообщить 1г в-ва, чтоб нагреть его на 1С  . С(мол)=
. С(мол)= 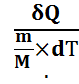 - молярная теплоемкость, кол-во т-ты, кот. нужно сообщить 1 молю в-ва, чтоб нагреть его на 1С
- молярная теплоемкость, кол-во т-ты, кот. нужно сообщить 1 молю в-ва, чтоб нагреть его на 1С  . С(уд)=
. С(уд)= 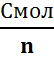 – связьмежду молярной и удельной теплоемкостью. Зависимость от степеней свободы: Сvмол =
– связьмежду молярной и удельной теплоемкостью. Зависимость от степеней свободы: Сvмол = 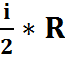 (газов. пост) – молярная теплоемкость при Vconst. Сpмол =
(газов. пост) – молярная теплоемкость при Vconst. Сpмол = 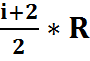 - при пост. давлении. Уравнение Майера: Сvмол + R= Cpмол
- при пост. давлении. Уравнение Майера: Сvмол + R= Cpмол
Поиск по сайту: