 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Занятие 14. Периодический закон и периодическая система
Элементов Д.И. Менделеева.
На занятии проводится тестовый контроль по теме «Строение атома».
Вариант билета
1. Сколько нейтронов в ядре атома элемента, строение валентных подуровней которого …3 d 64s2:
1) 30 2) 26 3) 56 4) 28
2. Ион, имеющий в своем составе 10 электронов и 9 протонов обладает зарядом равным:
1) +10 2) –10 3) –1 4) +1
3. Частицы: Сl–, Ar, K+, Ca2+ – имеют одинаковое:
1) массовое число 3) число протонов
2) число нейтронов 4) число электронов.
4. Электронная конфигурация иона S2– соответствует формуле:
1) 1 s 22 s 22 p 63 s 23 p 4 3) 1 s 22 s 22 p 63 s 23 p 2
2) 1 s 22 s 22 p 63 s 23 p 6 4) 1 s 22 s 22 p 63 s 23 p 64 s 2
5. Какое квантовое число характеризует размер электронного облака:
1) n 2) l 3) ml 4) ms
6. Укажите набор квантовых чисел для неспаренного электрона атома скандия:
1) 4, 0, 0, +1/2 2) 3, 2, 2, +1/2 3) 3, 1, 2, +1/2 4) 4, 2, 2, +1/2
7. У какого элемента начинается заполнение 4 р -подуровня и у какого элемента заканчивается?
1) Se и Fe 2) Сu и Se 3) Ga и Кr 4) Zn и Kr
& Вопросы для самостоятельной подготовки.
1. Формулировка периодического закона, данная Д.И. Менделеевым.
2. Современная формулировка периодического закона.
3. Структура периодической системы элементов (ПСЭ): периоды, группы, подгруппы. Их определения с точки зрения электронного строения атома.
4. Физический смысл порядкового номера элемента, номера периода и номера группы.
5. Предсказание форм и свойств соединений с помощью периодической системы элементов.
Пример характеристики элемента.
1) S – № 16, Ar (S) = 32, VI группа, главная подгруппа, 3 период.
2) 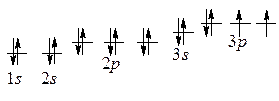 Z = 16, N = 16, N(е) = 16.
Z = 16, N = 16, N(е) = 16.
1 s 22 s 22 p 63 s 23 p 4
сера – р -элемент, неметалл
Валентные возможности: II, IV, VI.
Степени окисления: -2, 0, +4, +6.
3) Устойчивая аллотропная модификация серы ромбическая – простое вещество (S8) с ковалентной неполярной связью, молекулярной кристаллической решеткой, твердое.
4) SO3 – высший оксид, связь ковалентная полярная, молекулярная кристаллическая решетка, характер – кислотный.
5) Н2SO4 – серная кислота, гидрат высшего оксида, тяжелая маслянистая жидкость.
6) 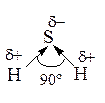
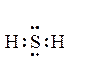 Н2S – сероводород, летучее водородное соединение, с ковалентной полярной связью:
Н2S – сероводород, летучее водородное соединение, с ковалентной полярной связью:
7) Другие соединения: Na2SО4 – сульфат натрия; Na2SO3 – сульфит натрия; Na2S – сульфид натрия.
Упражнения и задачи для самостоятельного решения.
1. В каком периоде, в какой группе и подгруппе находятся элементы с порядковыми номерами 15, 16, 23 и 24? Напишите для этих элементов электронные и электронографические формулы. Укажите для них:
а) максимально возможную степень окисления; б) валентность атома в соединении с водородом; в) формулы высших оксидов и гидроксидов, их кислотно-основные свойства.
2. По положению элементов в ПСЭ определите число энергетических уровней, число электронов на внешнем энергетическом уровне и число валентных электронов в атомах хлора, марганца, стронция, ксенона. Напишите для каждого из этих элементов электронные и электронографические формулы. К какому электронному семейству относятся эти элементы?
3. Массовая доля хлора в хлориде элемента III группы ПСЭ равна 90,8%. Определите относительную атомную массу элемента. (Ответ: бор)
4. При сгорании 4,7 г металла образовалось 8,88 г оксида. При действии на этот оксид КОН образуется соединение КМеО2. Какой это металл? (Ответ: алюминий)
5. Из 3,42 г гидроксида элемента, находящегося во II группе ПСЭ, получено 5,94 г его бромида. Какой это металл? (Ответ: Ва(ОН)2)
6. После того как 4,0 г оксида двухвалентного металла нагревали до постоянной массы в токе водорода, образовалось 3,143 г металла. Оксид какого металла был взят? Какой объем водорода (н.у.) был израсходован в реакции? (Ответ: Ni; 1,2 л)
7. При взаимодействии 1,95 г одновалентного металла с водой выделилось 560 мл водорода. Какой металл был взят? (Ответ: калий)
 Дополнительные задания
Дополнительные задания
1. Двухвалентный металл массой 13,63 г вытесняет из соляной кислоты
5 л водорода, измеренного при 18оС и 760 мм рт. ст. Чему равна относительная атомная масса металла? В каком периоде и какой группе он находится? (Ответ: Zn).
2. С точки зрения электронного строения предложите возможные валентности для атомов фтора и брома. Чем объясняется различие свойств этих элементов?
3. Объясните, почему хром и серу помещают в одну группу ПСЭ, но в разные подгруппы.
Поиск по сайту: