 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Символы элементов Электронные формулы
1) S А) …3 d 54 s 1
2) Zn Б) …3 d 44 s 2
3) Cr В) …3 d 104 s 24 р 2
4) Ge Г) …3 s 23 р 4
Д) …3 d 104 s 2
Е) …3 d 6
Решение:
1. Порядковый номер серы в ПСЭ – 16, поэтому в атоме S – 16 электронов. Сера является элементом 3-го периода VI-А группы ПСЭ, следовательно, в ее атоме происходит заполнение 3-го электронного слоя, на котором находится 6 электронов (соответственно номеру группы). Электронная конфигурация внешнего слоя атома серы 3 s 23 p 4 (ответ Г).
2. В атоме Zn всего 30 электронов. Цинк – элемент IV периода II-В группы, следовательно, в его атоме происходит заполнение 4-го электронного слоя. Заполненными в атоме являются 1, 2 и 3-й электронные слои, содержащие соответственно 2, 8, 8 электронов – в сумме 18. В 4-ом электронном слое атома находится 2 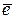 (соответствует номеру группы). Следовательно, 10
(соответствует номеру группы). Следовательно, 10 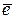 , оставшихся из суммарных 30
, оставшихся из суммарных 30 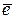 (30 – 18 – 2 = 10), расположены на 3 d -подуровне, и его конфигурация 3 d 104 s 2 (ответ Д).
(30 – 18 – 2 = 10), расположены на 3 d -подуровне, и его конфигурация 3 d 104 s 2 (ответ Д).
3. В атоме хрома всего 24 электрона. Хром расположен в 4-м периоде VI-В группе ПСЭ. Так как Cr – элемент побочной подгруппы, в его атоме происходит заполнение 3 d - и 4 s -орбиталей. Всего валентных электронов в атоме хрома 6 (соответственно номеру группы). Можно было бы ожидать для атома Cr распределение электронов 3 d 44 s 2, но следует знать, что в атоме Cr происходит проскок электронов с 4 s - на 3 d -подуровень и электронная конфигурация имеет вид: …3 d 54 s 1 (ответ А).
4. Атом Ge располагается в IV периоде IV-А группы ПСЭ и имеет 32 электрона. Это р -элемент, на внешнем четвертом энергетическом слое которого содержится 4 электрона: два из них на 4 s -орбитали и два – на 4 р -орбитали. Следовательно, электронная формула внешнего уровня атома Ge – …4 s 24 p 2.
Ответ
| Г | Д | А | В |
Упражнения и задачи для самостоятельного решения.
1. Назовите элемент, в атоме которого содержится 25 электронов. Напишите его электронную и электронографическую формулы.
2. Для атома элемента, находящегося в III периоде и II группе ПСЭ, укажите общее число электронов и их распределение по энергетическим уровням и подуровням.
3. Сколько полностью заполненных энергетических уровней имеют атомы бериллия, магния, кальция, стронция и бария?
4. Атом элемента имеет следующую электронную конфигурацию: 1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 3. Укажите: а) заряд ядра; б) число завершенных энергетических уровней в электронной оболочке этого атома; в) максимально возможную степень окисления; г) валентность атома в соединении с водородом.
5. Напишите электронные формулы ионов Br–, S2–, Ca2+, Cu2+, Cr3+, Mn2+.
6. Какую атомную орбиталь выберет очередной электрон согласно принципу наименьшей энергии: 4 d или 5 s; 4 d или 5 р; 5 f или 4 d?
7. Атомы каких трех элементов имеют структуру внешнего электронного слоя 4 s 1? Напишите их электронные формулы.
 Дополнительные задания
Дополнительные задания
1. С точки зрения электронного строения объясните, какой из двух ионов: Fe2+ или Fe3+ более устойчив и почему?
2. Атом какого элемента содержит столько же электронов, как и молекула аммиака?
3. Сколько электронов и протонов содержит молекула воды Н2О?
4. Изобразите, как располагаются 6 электронов на внешнем третьем уровне. Сколько орбиталей окажется вакантными на этом уровне?
Поиск по сайту: