 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 1
Между какими из указанных веществ реакции протекают до конца, какие реакции являются обратимыми, какие – в растворе не протекают? Почему?
1) NH4OH + HNO3 ®; 2) Na2S + H2SO4 ®; 3) AlCl3 + AgNO3 ®;
4) CH3COOH + KOH ®; 5) NaCl + H2SO4 ®.
Решение:
Составим для указанных веществ молекулярные и сокращенные ионные уравнения реакций:
1) NH4OH + HNO3 NH4NO3 + H2O
NH4OH + H+ NH 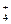 + H2O
+ H2O
2) Na2S + H2SO4 = Na2SO4 + H2S
S2– + 2H+ = H2S
3) AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl ¯
Ag+ + Cl– = AgCl ¯
4) CH3COOH + KOH «CH3COOK + H2O
CH3COOH + OH– «CH3COO– + H2O
5) 2NaCl + H2SO4 ¹ 2HCl + Na2SO4
2Na+ + 2Cl– + 2H+ + SO  - ¹ 2H+ + 2Cl– + 2Na+ + SO
- ¹ 2H+ + 2Cl– + 2Na+ + SO 
Реакции 2 и 3 являются необратимыми, так как в результате реакций один из продуктов уходит из сферы реакции: в виде газа – Н2S и в виде осадка – AgCl. Реакции 1 и 4 являются обратимыми, так как среди исходных веществ и продуктов реакции имеются слабые электролиты. Реакция 5 в водном растворе не протекает, так как исходные вещества являются сильными электролитами, которые при взаимодействии не образуют малорастворимые или малодиссоциирующие вещества. При смешивании этих веществ в растворе находится смесь ионов.
Упражнения и задачи для самостоятельного решения.
1. Напишите молекулярные, полные и сокращенные ионные уравнения следующих реакций: а) FeCl3 + KOH ®; б) СuSO4 + ВаCl2 ®;
в) AgNO3 + NaCl ®; г) Na2CO3 + HCl ®; д) СаСО3 + HCl ®;
е) СаО + НNO3 ®; ж) AlCl3 + 3NaOH ®; з) Al(OH)3 + H2SO4 ®;
и) Zn(OH)2 + NaOH ®.
2. Закончите уравнения реакций и укажите, какие из них: а) практически идут до конца; б) обратимы; в) не идут совсем:
AgNO3 + FeCl3 ®; NH4OH + HCl ®; HNO3 + NaOH ®; KNO3 + NaCl ®; KCl + H2S ®; K2S + HCl ®; ZnCl2 + NaOH(изб.) ®; AlCl3+NaOH(изб.) ®.
3. Какие ионы (попарно) будут связываться в малодиссоциирующие вещества в растворе, содержащем ионы: Н+, Ва2+, ОН–, Сu2+, SO 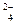 , К+, Сl–, Мg2+? Запишите уравнения реакций.
, К+, Сl–, Мg2+? Запишите уравнения реакций.
4. Могут ли в растворе одновременно находится следующие пары веществ: NaOH и Р2О5; Ва(ОН)2 и SO2; КОН и NaOH; КОН и Zn(ОН)2; NaHSO4 и ВаСl2; НСl и Al(NO3)3? Ответ подтвердите соответствующими уравнениями реакций.
5. К раствору смеси двух солей добавили избыток соляной кислоты. После окончания реакции в растворе кроме ионов Н+ и Сl– оказались только ионы Na+. Какие соли могли находится в исходном растворе? Напишите уравнения реакций.
6. Даны следующие вещества: сульфат железа(II), сульфид железа(II), аммиак, нитрат меди(II), хлороводород, оксид кремния(IV), серная кислота, едкий натр. Напишите не менее трех обменных реакций, протекающих попарно между предложенными веществами.
7. Запишите уравнения реакций в молекулярной и ионной форме на основании сокращенных ионных уравнений:
а) Са2+ + СО 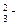 ® СаСО3¯; б) Сu2+ + S2– = CuS; в) Н+ + ОН– = Н2О;
® СаСО3¯; б) Сu2+ + S2– = CuS; в) Н+ + ОН– = Н2О;
г) 2Н+ + SO 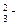 = Н2О + SO2; д) Mg(OH)2 + 2H+ = Mg2+ + 2H2O;
= Н2О + SO2; д) Mg(OH)2 + 2H+ = Mg2+ + 2H2O;
е) Fe3+ + 3OH– = Fe(OH)3¯.
 Дополнительные задания
Дополнительные задания
1. Закончите уравнения реакций, расставьте коэффициенты, укажите признаки необратимости реакций, составьте краткие ионные уравнения:
Н2S+KOH ®; CaCO3+HCl ®; NH4NO3+KOH ®; H3PO4+NaOH ®; FeCl3+NaOH ®; H3PO4+CaCl2 ®; Ba(NO3)2+Al2(SO4)3 ®.
3. Между растворами каких из перечисленных ниже веществ возможно протекание необратимых реакций: а) соляная кислота; б) карбонат натрия; в) нитрат серебра; г) сульфат калия? Составьте уравнения возможных реакций в молекулярном, полном ионном и сокращенном ионном виде.
4. Могут ли сосуществовать в растворе следующие пары веществ:
а) КОН и Р2О3; б) Ва(ОН)2 и СО2; в) Аl(NO3)3 и HCl; г) КОН и NaOH;
д) FeSO4 и Ba(NO3)2; е) Cr(OH)3 и КОН; ж) CuCl2 и AgNO3? Ответ поясните, записав молекулярные и ионные уравнения реакций.
5. К 120 мл 15%-ного раствора гидроксида аммония (пл. 0,94 г/мл) прилили 120 мл 28%-ного раствора азотной кислоты (пл. 1,15 г/мл). Как окрасится лакмус в полученном растворе? (Ответ: красный)
6. Напишите полные и сокращенные ионные уравнения следующих реакций:
H2S + NaOH ®; Al(OH)3 + HCl ®;
Al(OH)3 + Ba(OH)2 ®; СH3COOH+ КOH ®.
7. Какие реакции не идут в растворах?
NaCl+КОН®; NaCl + AgNO3 ®;
Al(NO3)3 + HCl ®; Al(NO3)3 + КOH®.
8. К раствору, содержащему смесь сульфита калия и хлорида натрия, сначала добавили избыток соляной кислоты, а затем нитрата серебра. Какие ионы остались в растворе? Ответ подтвердите уравнениями реакций.
9. К раствору хлорида алюминия прилили: а) избыток; б) стехиометрическое количество щелочи (Al + 3NaOH). В каком случае образовался осадок гидроксида алюминия? Составьте молекулярные и ионные уравнения реакций.
Поиск по сайту: