 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 2. Плотность смеси кислорода и озона по водороду равна 17
Плотность смеси кислорода и озона по водороду равна 17. Определите молярную долю кислорода в смеси.
Решение:
1. Находим среднюю молярную массу смеси газов:
М (смеси газов) = 2 D Н2;
М (смеси газов) = 2×17 = 34 г/моль.
2. Определяем количества вещества кислорода в смеси:
М (смеси) = n (O2)× M (O2) + n (O3)× M (O3).
Пусть n (O2) = х моль, тогда n (O3) = 1 – х;
М (смеси) = 32 х + (1 – х) 48 = 34;
х = 0,875 моль.
3. Определяем молярную долю кислорода в смеси:
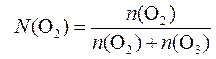 ;
;
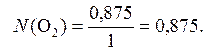
Ответ:N (O2) = 0,875.
Упражнения и задачи для самостоятельного решения
1. Смесь 11,2 л (н.у.) аммиака и водорода имеет массу 5,5 г. Определите объемную и массовую долю аммиака в этой смеси. (Ответ: 0,6; 0,927)
2. Массовая доля угарного газа СО в его смеси с углекислым газом составляет 40,54%. Найдите объемную долю СО в смеси. (Ответ: 51,7%)
3. Объемная доля хлороводорода в его смеси с хлором составляет 33,95%. Определите массовую долю хлороводорода в этой смеси.
(Ответ: 20,9%)
4. Какова объемная доля СО в смеси с СО2, если плотность по водороду этой смеси равна 20? (Ответ: 25%)
5. 1 л смеси угарного газа и углекислого при н.у. имеет массу 1,43 г. Определите состав смеси в объемных долях. (Ответ: 75% СО, 25% СО2)
6. К 50 мл смеси СО и СО2 добавили 50 мл кислорода, смесь сожгли, после чего ее объем, приведенный к нормальным условиям, составил
90 мл. Найдите объемную долю СО2 в исходной смеси. (Ответ: 60%)
7. Смесь оксидов углерода занимает объем 1,68 л (н.у.) и содержит 8,73×1023 электронов. Вычислите объемные доли газов в смеси.
(Ответ: 33,3% СО, 66,7% СО2)
 Дополнительные задания
Дополнительные задания
1. Вычислите объем углекислого газа, который добавили к 5,6 л оксида углерода(II) (н.у.), если известно, что число электронов в полученной смеси стало в 14,5 раз больше числа Авогадро. (Ответ: 11,2 л)
2. При сжигании 3,28 г смеси этана, этена и этина образовалось 5,376 л СО2 (н.у.). Сколько г воды при этом получилось? (Ответ: 3,6 г)
3. После взрыва 40 мл смеси водорода и кислорода осталось 4 мл водорода. Определите объемные доли газов в исходной смеси.
(Ответ: 60%Н2; 40% О2)
4. Через избыток известковой воды пропустили смесь газов объемом 5 л (н.у.), состоящую из СО, СО2 и азота. При этом образовался осадок массой 5 г. Оставшуюся смесь газов пропустили над нагретым оксидом железа(Ш) и получили железо массой 5,6 г. Каковы объемные доли газов в исходной смеси? (Ответ: 22,4% СО2; 67,3% СО; 10,3% N2)
Поиск по сайту: