 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 3. Используя метод электронно-ионного баланса составьте полные уравнения следующих окислительно-восстановительных реакций:
Используя метод электронно-ионного баланса составьте полные уравнения следующих окислительно-восстановительных реакций:
1) KClO3 + HCl 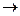 ; 2) Si + NaOH + H2O
; 2) Si + NaOH + H2O 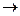 ; 3) KNO2 + KMnO4 + H2O
; 3) KNO2 + KMnO4 + H2O 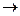 .
.
Решение:
1. В уравнении (1) KClO3 – окислитель, восстанавливается до Cl2;
Cl– – восстановитель, окисляется до Cl2.
2. Записываем схему реакции: KClO3 + HCl 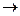 KCl + Cl2 + H2O.
KCl + Cl2 + H2O.
3. Составляем уравнения процессов окисления и восстановления с учетом характера среды:

 2ClO
2ClO  + 12H+ + 10
+ 12H+ + 10  = Cl2 + 6H2O 1
= Cl2 + 6H2O 1
2Cl– – 2  = Cl2 5
= Cl2 5
 |
2ClO  + 12H+ + 10Cl– = 6Cl2 + 6H2O.
+ 12H+ + 10Cl– = 6Cl2 + 6H2O.
Внимание! В левой части уравнения процесса окисления взято два хлорид-иона, т.к. продуктом окисления является двухатомная молекула Cl2. Все коэффициенты в полученном молекулярно-ионном уравнении кратны 2, поэтому запишем уравнение в следующем виде:
ClO  + 6H+ + 5Cl– = 3Cl2 + 3H2O.
+ 6H+ + 5Cl– = 3Cl2 + 3H2O.
4. Переносим коэффициенты в молекулярное уравнение реакции:
KClO3 + 6HCl = KCl + 3Cl2 + 3H2O.
5. В уравнении (2) H2O – окислитель, восстанавливается до H2;
Si – восстановитель, окисляется в щелочной среде до SiO 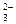 :
:
Si + NaOH + H2O 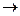 Na2SiO3 + H2.
Na2SiO3 + H2.
6. Составляем уравнения процессов окисления и восстановления:
 2H2O + 2
2H2O + 2  = H2 + 2OH
= H2 + 2OH  2
2
 Si + 6OH
Si + 6OH  – 4
– 4  = SiO
= SiO 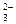 + 3H2O 1
+ 3H2O 1
4H2O + Si + 6OH  = 2H2 + 4OH
= 2H2 + 4OH  + SiO
+ SiO 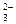 + 3H2O,
+ 3H2O,
приводим подобные члены:
H2O + Si + 2OH  = 2H2 + SiO
= 2H2 + SiO 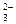 .
.
7. Переносим коэффициенты в молекулярное уравнение реакции:
Si + 2NaOH + H2O = 2H2 + Na2SiO3.
8. В уравнении (3) MnO  – окислитель, восстанавливается в нейтральной среде до MnO2; NO
– окислитель, восстанавливается в нейтральной среде до MnO2; NO  – восстановитель, окисляется до NO
– восстановитель, окисляется до NO  .
.
9. Записываем схему реакции: KNO2 + KMnO4 + H2O 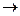 MnO2 + KNO3.
MnO2 + KNO3.
10. 
 Составляем уравнения процессов окисления и восстановления, приводим подобные:
Составляем уравнения процессов окисления и восстановления, приводим подобные:
MnO  + 2H2O + 3
+ 2H2O + 3  = MnO2 + 4OH
= MnO2 + 4OH  2
2
NO  + H2O – 2
+ H2O – 2  = NO
= NO  + 2H+ 3
+ 2H+ 3
 |
2MnO  + 3NO
+ 3NO 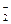 + 7H2O = 2MnO2 + 3NO
+ 7H2O = 2MnO2 + 3NO  +
+ 
11. Переносим коэффициенты в молекулярное уравнение реакции:
3KNO2 + 2KMnO4 + H2O = 2MnO2 + 3KNO3 + 2KOH.
Упражнения и задачи для самостоятельного решения.
1. Разделите вещества H2SO4, NH3, HCl, KMnO4, FeSO4, Na, H2, HNO2, HClO4, H2O2, F2 на 3 группы: а) вещества, проявляющие только окислительные свойства; б) вещества, проявляющие только восстановительные свойства; в) вещества, проявляющие как окислительные, так и восстановительные свойства.
2. Укажите, какие из перечисленных веществ могут проявлять только окислительные свойства (свойства катионов не учитывать): K2Cr2O7, H2O2, KМnO4, HCl(конц.), HNO3(разб.), Cl2, SO2, HBr.
3. Определите степень окисления атома хрома в следующих молекулах и ионах: Cr2O3; K2Cr2O7; KCr(SO4)2; CrO  ; [Cr(OH)6]3–; CrO3.
; [Cr(OH)6]3–; CrO3.
4. Расположите вещества в порядке возрастания их окислительных свойств: K2MnO4, MnO2, KMnO4, Mn2O3, MnCl2, Mn.
5. Какую роль в окислительно-восстановительных реакциях могут выполнять а) H2SO4 и H2S (за счет атомов серы); б) K2Cr2O7, Cr и CrCl3 (за счет атомов хрома)? Ответ поясните.
6. Какую роль в окислительно-восстановительных реакциях могут выполнять следующие ионы: Cl  , Fe2+, S2-, NO
, Fe2+, S2-, NO 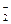 , SO
, SO 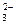 , Cu2+?
, Cu2+?
7. Расположите ионы в порядке уменьшения их восстановительных свойств: F–, At–, Cl–, I –, Br –.
 Дополнительные задания
Дополнительные задания
1. Подберите коэффициенты в уравнениях окислительно-восстановительных реакций методом электронного баланса. Определите тип окислительно-восстановительных реакций:
NH3 + O2  NO + H2O; KClO3
NO + H2O; KClO3  KCl + O2;
KCl + O2;
H2S + O2 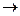 SO2 + H2O; Cl2 + KOH
SO2 + H2O; Cl2 + KOH  KCl + KClO3 + H2O.
KCl + KClO3 + H2O.
2. Составьте уравнение окислительно-восстановительной реакции. Укажите окислитель и восстановитель, процессы окисления и восстановления: NaCrO2 + Br2 + NaOH 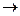 Na2CrO4 + NaBr + H2O.
Na2CrO4 + NaBr + H2O.
3. Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций ионно-электронным методом, укажите окислитель и восстановитель, процессы окисления и восстановления: Al + HNO3 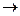 Al(NO3)3 + N2 + H2O; S + NaOH
Al(NO3)3 + N2 + H2O; S + NaOH 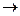 Na2S + Na2SO3 + H2O; SO2 + I2 + H2O
Na2S + Na2SO3 + H2O; SO2 + I2 + H2O 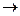 Н2SO4 + HI.
Н2SO4 + HI.
4. Окисление сероводорода водным раствором дихромата калия протекает в кислой среде по схеме:
К2Cr2O7 + H2S + H2SO4 ® Cr2(SO4)3 + S + K2SO4 + H2O.
5. Какой объем сероводорода (н.у.) прореагирует с 250 мл 0,25М раствора дихромата калия? Какая масса серы при этом образуется?
(Ответ: 4,2 л; 6 г)
6. Технический сульфит натрия массой 10 г растворили в воде и добавили 40 г раствора с массовой долей перманганата калия 7,9%. Реакция протекает в присутствии серной кислоты. Определите массовую долю сульфита натрия в техническом образце. (Ответ: 63%)
7. Какая масса оксида марганца (IV) и какой объем раствора соляной кислоты с массовой долей HCl 24% (пл.=1,12 г/мл) были израсходованы для получения хлора, если при действии его на раствор иодида калия образовалось 25,4 г йода? (Ответ: 8,7 г; 54,3 мл)
8. При растворении в соляной кислоте смеси железа и магния массой
10,4 г выделилось 6,72 л водорода (н.у.). Найдите массу каждого металла в смеси. (Ответ: 5,6 г Fe; 4,8 г Mg)
9. На 10,4 г смеси алюминия и оксида алюминия подействовали раствором гидроксида натрия. Выделившийся газ сожгли и получили 7,2 г воды. Определить массовые доли компонентов в смеси.
(Ответ: 69,2% Al; 30,8% Al2O3)
Поиск по сайту: