 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 2. Из 17,55 г хлорида натрия получили сульфатным способом хлороводород, который пропустили через раствор нитрата серебра(I)
Из 17,55 г хлорида натрия получили сульфатным способом хлороводород, который пропустили через раствор нитрата серебра(I). При этом образовался осадок массой 32,29 г. Определите выход хлороводорода в первой реакции, считая, что выход продукта второй реакции количественный.
Решение:
1. Запишем уравнения протекающих реакций:
NaCl(кр) + H2SO4(конц)  NaHSO4 + HCl (1)
NaHSO4 + HCl (1)
HCl + AgNO3 = AgCl¯ + HNO3 (2)
2. Находим n (AgCl):
n (AgCl) =  ; n (AgCl) =
; n (AgCl) =  = 0,225 моль.
= 0,225 моль.
3. Находим количество вещества HCl, которое прореагировало с нитратом серебра и реально получено в первой реакции.
Так как выход продукта второй реакции количественный, т.е. 100%-ный, то n (HCl) = n (AgCl) и, следовательно, n (HCl)практ = 0,225 моль.
4. Рассчитываем количество вещества NaCl:
n (NaCl) =  ; n (NaCl)=
; n (NaCl)=  0,3 моль.
0,3 моль.
5. Из уравнения (1) следует, что n (HCl)теор = n (NaCl) = 0,3 моль.
6. Находим выход хлороводорода:
h(HCl) =  ; h(HCl) =
; h(HCl) =  .
.
Ответ: 75%.
Задача № 3
Газ, полученный при обжиге 120 г пирита, использовали для полной нейтрализации раствора, содержащего 152 г гидроксида натрия. Определите массовую долю примесей в пирите.
Решение:
1. Записываем уравнения происходящих реакций:
4FeS2 + 11O2  2Fe2O3 + 8SO2 (1)
2Fe2O3 + 8SO2 (1)
2. По условию задачи нейтрализация щелочи полная, поэтому образуется средняя соль:
SO2 + 2NaOH = Na2SO3 + H2O (2)
3. Находим количество вещества NaOH:
n (NaOH) = 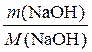 ; n (NaOH) =
; n (NaOH) =  .
.
4. Находим количество вещества SO2 и FeS2:
по уравнению (2) n (SO2) = 1/2 n (NaOH) = 1/2×3,8 = 1,9 моль;
по уравнению (1) n (SO2): n (FeS2) = 2: 1, следовательно,
n (FeS2) = 1,9×1/2 = 0,95 моль.
5. Находим массу FeS2:
m (FeS2) = n (FeS2)× M (FeS2);
m (FeS2) = 0,95моль×120г/моль = 114 г.
6. Рассчитываем массу и массовую долю примесей в пирите:
m (примесей) = m (руды) – m (FeS2); m (примесей) = 120г– 114г = 6 г;
w(примесей)=  ; w(примесей)=
; w(примесей)=  = 5%.
= 5%.
Ответ: 5% примесей.
Поиск по сайту: