 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 2. 1 л 0,1М раствора НNO2 содержит 6,15×1022 недиссоциированных молекул и образовавшихся ионов
1 л 0,1М раствора НNO2 содержит 6,15×1022 недиссоциированных молекул и образовавшихся ионов. Определите степень диссоциации азотистой кислоты.
Решение:
Определим количество недиссоциированных молекул и образовавшихся ионов:
n (частиц) = 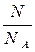 =
= 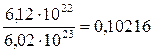 моль.
моль.
HNO2 H+ + NO 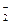 . Пусть продиссоциировало х моль молекул HNO2. В соответствии с уравнением электролитической диссоциации:
. Пусть продиссоциировало х моль молекул HNO2. В соответствии с уравнением электролитической диссоциации:
HNO2 H+ + NO 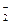
n дис.(НNO2) = n (Н+) = n (NO 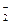 ) = х моль.
) = х моль.
Количество недиссоциированных молекул НNO2 будет равно:
n недис.(НNO2) = n общ.(НNO2) – n дис.(НNO2) = (0,1 – х) моль.
Общее число частиц в растворе складывается из числа образовавшихся ионов Н+ и NO 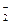 , а также недиссоциированных молекул HNO2:
, а также недиссоциированных молекул HNO2:
n (частиц) = n (Н+) + n (NO 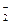 ) + n недис.(НNO2) = х + х + (0,1 – х) = 0,1 + х;
) + n недис.(НNO2) = х + х + (0,1 – х) = 0,1 + х;
0,1 + х = 0,10216; х = 0,00216 моль.
Рассчитаем степень диссоциации: 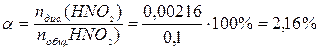 .
.
Ответ: 2,16%.
Упражнения и задачи для самостоятельного решения.
1. Как называются и чем различаются между собой следующие частицы: а) Cl–, Cl, Cl2; б) SO  , SO3; в) Na, Na+?
, SO3; в) Na, Na+?
2. Напишите формулы электролитов, в водных растворах которых содержатся ионы:
а)Al3+ и SO  ; б) К+ и Сr2О
; б) К+ и Сr2О 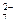 ; в) Ва2+ и ОН-; г) Са2+ и NO
; в) Ва2+ и ОН-; г) Са2+ и NO 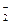 ;
;
д) Cr3+ и NO 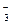 ; е) Mn2+ и Br-; ж) Na+ и НСО
; е) Mn2+ и Br-; ж) Na+ и НСО 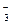 ; з) К+ и СО
; з) К+ и СО 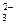 ;
;
и) Na+ и СlО 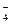 ; к) Са2+ и НСО
; к) Са2+ и НСО 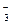 .
.
3. Составьте уравнения диссоциации следующих электролитов: Ва(ОН)2; Мg(ОН)2, Al(ОН)3; HNO3; H2CO3; H2SO4; KHCO3; (FeOH)2SO4.
4. Составьте уравнения диссоциации следующих электролитов: (CuOH)2SO4; Al(OH)Cl2; K2HPO4; Na2S; Mg(HCO3)2; H2SO3; Fe(OH)2. Какие из этих электролитов образуют в растворе гидроксид-ионы?
5. Какие из следующих электролитов образуют в растворе одновременно ионы водорода и гидроксид-ионы: KOH; Sr(OH)2; H2O; Pb(OH)2; Cа(HCO3)2; Sn(OH)2; Cr(OH)3; Al(OH)3? Напишите уравнения электролитической диссоциации этих веществ.
6. Определите, какие из указанных электролитов являются сильными, а какие слабыми электролитами: Са(ОН)2, Н2СО3, СuSO4, H2SO4, Cu(OH)2, HF, H2S.
7. Напишите уравнения диссоциации Na3PO4, H2S, ZnSО4, Al(OH)2Cl и укажите степень диссоциации (a = 1; a << 1) для каждого вещества.
 Дополнительные задания
Дополнительные задания
1. Вычислите массу катионов и анионов в 500 мл 0,3М раствора нитрата бария. (Ответ: 20,55 г, 18,6 г)
2. Определите общее число частиц в растворе, содержащем 0,1 моль слабой одноосновной кислоты, если степень ее диссоциации равна 2%. (Ответ: 6,14×1022)
3. При растворении кислот в воде образуется ион гидроксония Н3О+. Представьте схему образования этого иона? По какому механизму он образуется?
4. Составьте уравнения диссоциации электролитов СrCl3, KClO3, Al(OH)2Cl, Ca(ClO)2, HClO4, NaClO, MgOHCl. Какие из этих электролитов образуют в водном растворе хлорид-ионы.
Поиск по сайту: