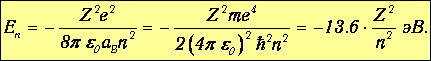|
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Энергия электрона на стационарной орбите
| (3.3) |
Константа аВ, имеющая размерность длины, называется радиусом Бора (аВ = 5.29 · 10-11 м). Смысл числа п - номер разрешенной орбиты. Радиус Бора - радиус низшей орбиты (п=1) в атоме водорода (Z=1). Если устремить к нулю значение постоянной Планка, то получаем, что радиус Бора стремится к нулю: падение электрона на ядро - как в классической физике.
Формула (3.3) определяет дискретные значения энергии, которые может иметь электрон в атоме водорода, или, как говорят, энергетические уровни. Отрицательные значения Еп соответствуют связанным состояниям электрона в атоме, то есть движениям в ограниченной области пространства (аналог в классической физике - движение планет по эллипсам в отличие от гиперболических траекторий, уходящих на бесконечность).
При решении задач о поведении электрона в атоме обычно возникают выражения, включающие квадрат электрического заряда электрона е2 в комбинации с электрической постоянной e0. Для выполнения численных расчетов удобно ввести так называемую постоянную тонкой структуры:

| (3.4) |
Приведем для справки формулу для энергии (3.3), выраженной через постоянную тонкой структуры:
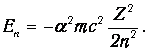
Из-за множителя a2 характерные для атома энергии оказываются на четыре порядка меньше энергии покоя электрона. Это проявление нерелятивизма атомных систем.
Пример 1. Определим скорость электрона на n -й орбите атома Бора. Радиус п-й орбиты определяется формулой
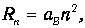
где аВ - радиус Бора. Скорость электрона v можно выразить через момент импульса L=nh:

Выражение для радиуса Бора упростим, используя введенную постоянную тонкой структуры:

| (3.5) |
Подставляя это выражение в полученную выше формулу для скорости электрона, получаем для n -й орбиты
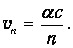
Отсюда вытекает, что на низшей орбите скорость электрона приблизительно в 137 раз меньше скорости света, то есть атом - действительно нерелятивистская система. На n -й орбите скорости электрона в п раз меньше, чем на первой. Численный пример: на второй орбите скорость электрона равна
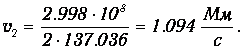
При переходе с уровня k на уровень п (k>п) излишек энергии Еk-Еп перейдет в энергию фотона hvnk. Поэтому для спектра излучаемых частот получаем соотношение (ср. (3.1))
| (3.6) |
Таким образом, теория Бора позволила также вычислить постоянную Ридберга. Стало понятно и существование спектральных серий, и предельных значений lп,MIN (рис. 3.3).

Рис. 3.3. Схема энергетических уровней в атоме Бора: переходы электрона с высшего на низший уровень для каждой серии линий соответствуют длинам волн l1,MIN, l2,MIN, l3,MIN и т.д.
Экспериментальное подтверждение гипотеза Бора нашла в опытах Франка-Герца, которые заключались в бомбардировке паров ртути электронами в вакуумной трубке и измерении зависимости анодного тока от ускоряющей разности потенциалов. Схема опыта приведена на рис. 3.4.
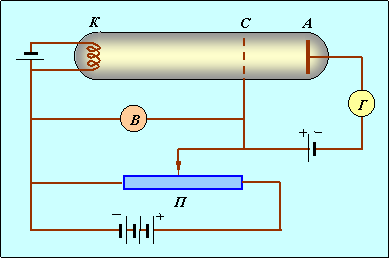
ис. 3.4. Схема опыта Франка-Герца
В трубке, заполненной парами ртути под небольшим давлением (около 1 мм. рт. ст.), имеются три электрода: анод А, катод К и сетка С. Электроны, вылетающие с поверхности подогретого катода вследствие термоэлектронной эмиссии, ускоряются напряжением U, приложенным между катодом и сеткой. Это напряжение можно менять с помощью потенциометра П. Между анодом и сеткой приложено слабое обратное поле с разностью потенциалов порядка 0.5 В, тормозящее движение электронов к аноду. Определялась зависимость тока I в цепи анода от приложенного напряжения U. Полученные результаты приведены на рис. 3.5.
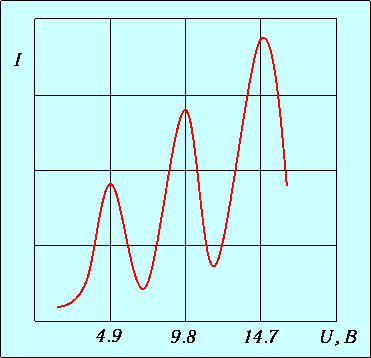
Рис. 3.5. Зависимость тока I в цепи анода от приложенного напряжения U в опыте Франка-Герца
Сила тока сначала монотонно возрастает, достигает максимума при напряжении 4.9 В, после чего с ростом U резко падает, достигает минимума и снова начинает расти. Максимумы силы тока повторяются при напряжениях 9.8 В, 14.7 В и т.д. Чередование максимумов на равном расстоянии друг от друга доказало дискретность изменения энергии атома.
Пример 2. При переходе с третьего уровня на второй (головная линия серии Бальмера) водородоподобный ион атома некоторого элемента испускает фотон с энергией 7.5 эВ. Определим, какой это элемент.
Энергия электрона, находящегося на п- й орбите около ядра с зарядом Ze, равна
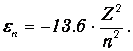
При переходе с уровня п=3 на уровень п=2 выделяется энергия
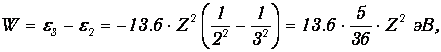
откуда
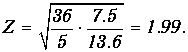
Атомный номер элемента - целое число, так что после округления получаем Z=2, что соответствует гелию.
Как отмечалось выше, еще до появления теории Бора был изучен спектр водородного атома и эмпирически установлена формула (3.1). Но при наблюдении спектра Солнца были замечены линии, казалось бы, нарушающие эту формулу, так как они соответствовали полуцелым значениям n и k. После появления теории Бора стало ясно, что квантовые числа п и k все-таки должны быть целыми, а кажущиеся полуцелые значения можно объяснить по-другому. Действительно, из формулы (3.6) для частот, испускаемых водородоподобным атомом,следует, что
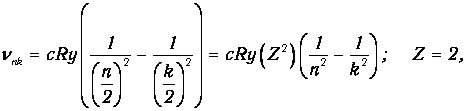
то есть наблюдавшиеся линии принадлежат иону элемента с Z=2. Как известно, этот элемент носит «солнечное» имя - гелий.
Поиск по сайту: