 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тест тапсырмалары 1 страница
ХИМИЯ
АЛМАТЫ 2013
УДК 54
Құрастырушылар: Ысқақова Р. А., Әлібекова Р. А., Алдамжарова С. Х. Химия. Оқу құралы. – Алматы: Азаматтық авиация академиясы, 2013 – 196 б.
Оқу құралы «Химия» курсы бойынша қойылған талаптарға сәйкес құрастырылған. Бұл құралда химияның маңызды сұрақтары – химияның негізгі түсініктері мен заңдары, бейорганикалық қосылыстардың негізгі кластары, химиялық реакциялардың жалпы заңдылықтары, ерітінділер, электр энергиясының қайнар көзі болып табылатын тотығу-тотықсыздану реакциялары, металдардың физикалық және химиялық қасиеттері –бойынша теориялық материалдар берілген және оларды бекіту үшін әрбір тақырыпқа тест тапсырмалары құрастырылған.
Оқу құралы бакалавриат және колледждің авиациялық мамандықтарының студенттеріне арналған.
©Ысқақова Р. А., Әлібекова Р. А.,
Алдамжарова С. Х. 2013ж
Мазмұны
| Кіріспе | ||
| № 1 дәріс | Химияның негізгі түсініктері мен заңдары | |
| № 2 дәріс | Бейорганикалық қосылыстардың негізгі кластары | |
| № 3 дәріс | Атом құрылысы | |
| № 4 дәріс | Химиялық элементтердің периодтық жүйесі | |
| № 5 дәріс | Химиялық байланыс | |
| № 6 дәріс | Химиялық процестердің энергетикасы | |
| № 7 дәріс | Химиялық кинетика | |
| № 8 дәріс | Химиялық тепе-теңдік | |
| № 9 дәріс | Ерітінділердің жалпы қасиеттері. Ерітінділер концентрациясын анықтау жолдары. Ерігіштік | |
| №10дәріс | Ерітінділердің жалпы қасиеттері. Сұйылтылған бейэлектролит ерітінділерінің физикалық және химиялық қасиеттері | |
| №11 дәріс | Ерітінділердің жалпы қасиеттері. Электролит ерітінділері | |
| №12 дәріс | Тотығу- тотықсыздану үрдістері | |
| №13дәріс | Сулы ерітінділердегі тотығу-тотықсыздану реакциялары. Электрохимиялық үрдістер | |
| №14дәріс | Сулы ерітінділердегі тотығу-тотықсыздану реакциялары. Электролиз | |
| №15дәріс | Металдар мен құймалардың қасиеттері. Коррозия және металдар мен құймаларды коррозиядан қорғау | |
| Әдебиеттер тізімі | ||
| Қосымша деректер |
Кіріспе
Әрқашанда химияның адамға деген маңызы зор. Ежелде химиялық құбылыстардың арқасында адамдар металл, шыны, бояулар жасайтын.
Жалпы химия химиялық өзгерістердің барлығына қатысы бар заңдылықтар мен теориялық мәселелерді зерттейді. Химияның негізгі міндеттеріне осы ғылымның жетістіктерін пайдалана отырып өнеркәсіпке, көлікке, ауыл шаруашылығына, тұрмысқа қажетті өнімдерді химиялық жолмен өндіру жатады.
Көптеген химиялық реакциялар энергия бөлу арқылы жүреді. Осы энергияны отын ретінде, іштен жанатын қозғалтқыштарда, космос ракеталарында қолдану химияның міндеттеріне жатады.
Өнеркәсіпті химияландыру техникалық үрдістердің негізгі шарттарының бірі. Химияның осы кездегі жетістіктерін пайдаланудың нәтежесінде өнеркәсіп пен көлікке қажетті жоғары сапалы болаттар және балқымалар, ұшақтар мен автомобильдердің дөңгелектеріне қажетті өте шыдамды резиналар, әртүрлі жартылай өткізгіштер, электротехникаға қажетті оқшаулаушы заттар, атом энергетикасы мен ғарыш техникасына қажетті материалдар мен жоғары калориялы жанғыш қосылыстар, пластмассаның, жасанды талшықтардың көптеген түрлерін өндіру мүмкін болды.
Қазіргі кезде дүние жүзілік маңызы бар мәселелердің бірі - қоршаған ортаны қорғау. Сондықтан химияның бұл саладағы мақсаты өнеркәсіптер мен көліктің жұмыс істеуі кезінде бөлінетін улы заттарды залалсыздандыру немесе пайдалы қосалқы өнімдерге айналдыру.
Жоғары оқу орнында химиядан берілетін білім - қазіргі дүниенің ғылыми бейнесін түсінуге үлкен үлес қосады. Ол бүкіл әлемді құрайтын заттарды, олардың құрамы мен құрылысын, бір-біріне айналу жолдарын, адамзат қажетіне пайдалану мен күнделікті тұрмыста қолдану тәсілдерін қөрсетіп береді. Мұндай түбегейлі мәселелерді жүйелі түрде оқыту студенттердің танымдық көзқарасын қалыптастыруға тікелей әсер етеді.
Студенттер алған білімдерін өздерінің алдағы тәжірибелік қызметінде жаңа құрылымдық материалдарды таңдау барысында, авиациялық техниканы қолдануда, химиялық электр энергия көздерін талғау және коррозиядан қорғану әдістерін жасауда, авиациялық техникаға сенімділікті арттыру, сонымен бірге ұшуда қауіпсіздік әдістерін іске асыра алады.
№ 1 дәріс. Химияның негізгі түсініктері мен заңдары
1. Дәрістің мақсаты:
Химия пәнінің жалпы түсініктері мен заңдары, атом-молекулалық ілім туралы студенттердің білімін тереңдету.
2. Дәрістің жоспары:
1. Химия жаратылыстану пәні ретінде.
2. Атом, молекула, салыстырмалы атомдық масса, моль. Атомдық және молекулалық массаларды анықтау. Химиялық таңбалар, формулалар, химиялық теңдеулер.
3. Химия заңдары: заттардың массаларының сақталу, құрам тұрақтылық, еселік қатынастар, Авогадро, біріккен газ заңдары.
4. Атом-молекулалық ілім.
3. Дәрістің мазмұны:
химия жаратылыстану пәні ретінде
Химия заттар және олардың қасиеттері мен өзгерістері туралы ғылым.
Химия пәні – жаратылыстану ғылымын құрайтын жүйенің маңызды бір бөлігі. Ол басқа да жаратылыстану пәндерімен – физика, биология, геология және т.б. – тығыз байланыста. Қазіргі ғылымның біраз бөлімдері физикалық химия, геохимия, биохимияның қиылысқандығынан бір-бірімен тығыз байланысынан пайда болған. Химия ғылым және техниканың тағы да басқа салаларымен тығыз байланысқан. Математикалық әдістер, компьютерлермен жүргізілетін есептер химияда кең түрде қолданылады.
Қазіргі заман химиясында бірнеше тараулар өздігінен бөлініп шыққан. Солардың ішіндегі маңыздылары бейорганикалық химия, органикалық химия, полимерлер химиясы, аналитикалық химия, электрохимия және коллоидтық химия.
Атом, молекула, салыстырмалы атомдық масса, моль. Атомдық және молекулалық массаларды анықтау. Химиялық таңбалар, формулалар, химиялық теңдеулер.
Химиялық элемент - ядро заряды бiрдей атомдар түрі, ол периодтық жүйедегі элементтердің реттік нөміріне тең.
Атом – заттар құрамына кіретін химиялық элементтің ең кіші бөлшегі.
Атомның әрбір жеке түрін химиялық элемент деп атайды. Қазіргі кезде 116 химиялық элемент белгілі.
Молекула – заттың физикалық және химиялық қасиеттерін сақтайтын ең кіші бөлшегі. Молекула атомдардан тұрады.
Молекулалары бiрдей элемент атомдарынан тұратын заттарды жай заттар дейдi. Мысалы, жай заттар: хлор – Сl2 хлор атомдарынан тұрады, азот – N2 азот атомдарынан тұрады. Кейбiр жай заттардың молекулалары бiр атомнан тұрады. Оларға көбiнесе металдар жатады. Мысалы, натрий, калий, кальций, алюминий және т.б.
Молекулалары әр түрлi элемент атомдарынан тұратын заттарды күрделi заттар деп атайды. Мысалы, азот (II) оксидi –NO азот және oттeк атомдарынан тұрады.
Элементтердің салыстырмалы атомдық массалары массаның атомдық бipлiгi ретiнде атомдық массасы 12-ге тең болатын көмipтeк изотопы массасының 1/12 бөлiгi қабылданды. Көміртек атомының абсолютті массасы:
ма (С) = 2,0•10-23г = 2,0• 10-25кг
Оның 1/12 бөлiгi массаның атомдық бiрлiгi (м.а.б.) деп аталады:
1 м.а.б.= 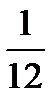 ма (С) = 1,667•10-27кг
ма (С) = 1,667•10-27кг
Салыстырмалы атомдық масса (Ar) дегенiмiз сол элемент атомы массасының көміртек атомы массасының 1/12 атомдық бiрлiгiнен неше есе ауыр екендiгiн көpceтeтін сан.
Элементтердiң салыстырмалы атомдық массалары химиялық элементтердің периодтық жүйесінде (Д.И.Менделеевтің кестесiнде) көрсетiлген. Салыстырмалы атомдық мaccaны 1 м.а.б. көбейту арқылы элементтiң атомдық массасын (Ar) табады, мысалы Ar(О) = 16•1 м.а.б. = 16 м.а.б., Ar(С) = 12•1 м.а.б. = 12 м.а.б.
Салыстырмалы молекулалық масса дегенiмiз зат молекуласы массасының массаның атомдық бiрлiгiнен (м.а.б.) неше есе ауыр екендiгiн көрсететін сан.
Молекулалық масса оны құрайтын атомдар массаларының қосындысынан тұратындықтан молекулалық масса да массаның атомдық бiрлiгiмен көрсетiледі.
Салыстырмалы молекулалық массаны табу үшiн молекула құрамына кipeтiн барлық атомдардың салыстырмалы атомдық массаларын қосу керек.
Мысалы, судың молекулалық массасы:
Мr (Н2О) = I•2 +16 = 18 м.а.б.
Заттың массасы граммен (г), килограммен (кг) өлшенедi. Химияда зат мөлшерi өлшемi ретiнде моль алынғaн.
Моль дегенiмiз көміртек атомының 0,012 кг-дағы зат мөлшерiнің, яғни қанша молекулалар, атомдар немесе иондар бар eкeнiн көpceтeтiн сан. Көмipтeгiнің 12 грамында 6,02 • 1023 атомдар болатындығын зерттеулер анықтаған. Кез келген заттың 1 молiнде 6,02•1023 бөлшек болады. Бұл санды Aвoгaдpo саны деп атайды. Сонымен, заттың 1 молiнде 6,02•1023 атом болса, онда оның екі молiнде 2•6,02•1023 =12,04•1023 атом болады.
Молярлық масса деп заттың 1 моль мөлшерiнің массасын айтады. Оны г/моль немесе кг/мольмен көрсетедi.
Мысалы, күкipт қышқылының молекулалық массасы:
Мr(H2S04) = 1•2 + 32 + 16•4 = 98 г/моль
Валенттілік. Валенттік деп осы элемент атомының басқа элементтердің атомдарымен қосылғанда түзетін байланыстарының санын айтады.
Сутек атомы әр уақытта элементтермен бір валенттілік байланыс түзу арқылы қосылады. Сондықтан, химиялық қосылыстардағы басқа элементтердің валенттілігін сутектің қанша атомымен байланысып тұрғандығына қарап анықтайды. Осыған сәйкес қосылыстарда басқа элементтің атомы сутектің неше атомымен қосылып тұрса, ол сонша валентті болады. Мысалы, 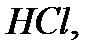
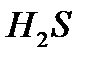 ,
, 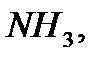
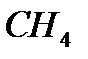 қосылыстарында хлор бір, күкірт екі, азот үш, көміртек төрт валентті болады. Бұл айтылғандардан сутекпен қосылыс түзетін элементтердің валенттіліктерін сол қосылыстардағы сутектің атом сандары арқылы анықтауға болатынын көруге болады.
қосылыстарында хлор бір, күкірт екі, азот үш, көміртек төрт валентті болады. Бұл айтылғандардан сутекпен қосылыс түзетін элементтердің валенттіліктерін сол қосылыстардағы сутектің атом сандары арқылы анықтауға болатынын көруге болады.
Көпшілік элементтер оттекпен қосылыс түзетіндіктен олардың валенттіліктерін оттек арқылы анықтауға болады. Оттек атомы басқа элементтердің атомдарымен екі валенттік байланыс түзу арқылы қосылады. Сол себептен 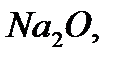
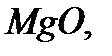
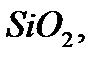
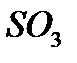 қосылысындағы натрий бір, магний екі, кремний төрт, күкірт алты валентті болады.
қосылысындағы натрий бір, магний екі, кремний төрт, күкірт алты валентті болады.
Химиялық элементтер тек сутекпен немесе оттекпен ғана қосылыс түзіп қоймайды, олар бір бірімен де әрекеттесіп алуан түрлі заттар түзеді. Бұл қосылыстардағы кез келген элементтің валенттілігін онымен қосылатын басқа элементтің белгілі валенттілігі арқылы анықтауға болады. Мысалы, 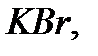
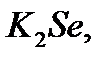
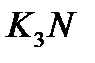 қосылыстарында бір валентті калиймен байланысып тұрған бром бір, селен екі, азот үш валентті.
қосылыстарында бір валентті калиймен байланысып тұрған бром бір, селен екі, азот үш валентті.
Элементтердің валенттіліктері бойынша қосылыстың формуласын құрастыру мына ережеге негізделеді: қосылыстағы бір элементтің валенттілігінің жалпы саны екінші элементтің валенттілігінің жалпы санына тең болады.
Элементтің эквивалентi деп сутек атомдарының 1 молiмен әрекеттесетiн немесе сондай молiн қосылыстан ығыстыратын мөлшерiн айтaды.
Сутектің эквивалентi Э(Н) = 1, алюминий эквивалентi Э(Аl) = 9.
Атомдық және молекулалық массадан эквиваленттiң айырмашылығы, оның шамасы айнымалы. Мысалы, көміртеê ауыспалы валенттiлiк көрсетедi: eкi валенттi көміртектің эквивалентi Э(С)=12/2=6, ал төрт валенттi көміртектің эквивалентi Э(С)=12/4=3.
Элементтер мен күрделі заттардың эквиваленттерi төменде көрсетілген формулалармен есептелiнедi:
Ээлемент = элементтiң атомдық массасы / элементтiң валенттiлiгi
Эқышқыл = мол. масса/негiздiгi
Энегіз = мол. масса/металл валенттiлiгi
Этұз = мол. масса/металл валенттiлiгi•металл атомдарының саны
Эквиваленттiк масса – заттың 1 эквивалентiнiң массасы (г/моль, кг/моль-мен көрсетiледi.)
Мысалы, cyтектің эквиваленттiк массасы Э(Н)=1г/мольге тең, натрийдiң эквиваленттiк массасы Э(Nа)=23 г/мольге тең. Эквивалент көлемi - белгiлi жағдайда заттың 1 эквивалентiнiң көлемi. Қалыпты жағдайда cyтeктің эквиваленттiк көлемі 11,2 л тең.
Химияның негізгі заңдары
Заттардың массаларының сақталу заңы. М.В. Ломоносов ұнтақталған металды жабық ыдыста қыздыру арқылы тотықтырып, реакцияға қатысқан заттардың массаларының реакциядан кейін де өзгермей қалатындығын байқаған. Осындай тәжірибелердің нәтижелерін қорытындылай келіп, М.В. Ломоносов 1748 жылы аса маңызды табиғат заңдарының бірі – заттардың массаларының сақталу заңын ашты. Бұл заңның анықтамасы қазіргі кезде былай айтылады: реакцияға қатысқан заттардың массалары реакция нәтижесінде түзілген заттардың массаларына тең болады.
Атом-молекулалық ілім тұрғысынан қарағанда бұл заңды былай түсіндіруге болады. Реакцияға қатысқан заттардың құрамында қандай атомдар қанша мөлшерде болса, реакция нәтижесінде шыққан заттардың құрамында сондай атомдар сонша мөлшерде болады. Химиялық реакциялар кезінде атомдардың массалары өзгермейтіндіктен реакцияға қатысқан заттардың массалары тұрақты болады. Барлық химиялық реакциялар заттар массаларының сақталу заңына бағынады.
Құрам тұрақтылық заңы. Заттардың массаларының сақталу заңы заттың сандық құрамын зерттеуге негіз салды. Егер реакцияға қатысқан және реакция нәтижесінде шыққан заттардың массалары тұрақты болса, онда сол заттардың құрамы да тұрақты болу керек деген пікір туды. Көптеген зерттеулер химиялық таза заттардың сапалық және сандық құрамы тұрақты болатынын көрсетті.
Француз ғалымы Ж.Л. Пруст көптеген тәжірибелердің нәтижелерін қорытындылай келіп 1808 жылы химияның негізгі заңдарының бірі құрам тұрақтылық заңын ашты:
Алыну тәсілдеріне қарамастан әрбір химиялық молекулалық қосылыстың сапалық және сандық құрамы тұрақты болады.
Мысалы, су молекуласын мынадай әр түрлі тәсілдермен алуға болады:
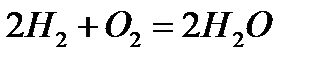
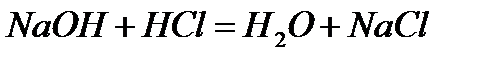
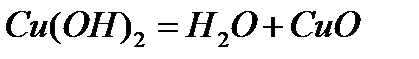
Бірақ, қандай жолмен алынса да, су молекуласы сапалық құрамы жағынан сутек пен оттектен, сандық құрамы жағынан екі атом сутектен және бір атом оттектен тұрады. Қандай жолмен алынса да су молекуласының құрамында 11,2% сутек, 88,8% оттек болады.
Атом-молекулалық ілім тұрғысынан қарағанда әрбір химиялық қосылыстың молекуласы атомдардың белгілі бір санынан тұрады. Бұл атомдардың әрқайсының массасы тұрақты болады. Олай болса кез келген молекуланың массалық құрамы алыну тәсілдеріне қарамастан әрқашан да тұрақты болады.
Еселік қатынас заңы. Бұл заңды ағылшын ғалымы Д. Дальтон1803 жылы тұжырымдады: егер екі элемент бірнеше химиялық қосылыстар түзетін болса, онда бірдей мөлшердегі элементтің біреуіне өзара қатынасы жай бүтін сандардың қатынасындай болатын екінші элементтің әр түрлі мөлшері сәйкес келеді.
Мысал ретінде көміртектің оттегімен екі қосылысын алуға болады:
| Қосылыс | Құрамы,% | Оттек массасының көміртектің бір өлшем бірлігіне келетін мөлшері |
| СО (II) | 43% + 57% | 1,33 |
| СО2 (IУ) | 27,3% + 72,7% | 2,66 |
Бұл заң негізінде СО және СО2 түзілуі кезіндегі бірдей мөлшердегі көміртегімен қосылысқан оттек массасын есептеуге болады. Ол үшін бірінші және екінші тотықтағы оттек және көміртек мөлшерін бір-біріне бөлеміз. Мұның нәтижесінде СО2 құрамына кіретін оттегі мөлшері СО-ға қарағанда 2 есеге көп екендігі анықталады. Бұдан шығатын қорытынды: элементтер химиялық қосылыстар құрамына белгілі үлеспен енеді.
Газдардың көлем қатынас заңы және Авогадро заңы. Көлем қатынас заңын француз ғалымы Гей-Люссак тұжырымдады: реакцияға қатысатын газдар көлемдерінің бір-біріне қатынасы және түзілетін заттар көлеміне қатынасы жай бүтін сандардың қатынасындай болады.
1811 жылы итальян физигі А. Авогадро реакцияласушы газдардың көлемдерінің арасындағы қарапайым қатынасты түсіндіру үшін өзінің ғылыми жорамалын ұсынды. Бұл жорамал көптеген тәжірибелер арқылы дәлелденіп, авогадро есімімен аталған заңға айналды. Заңның анықтамасы былай айтылады: бірдей жағдайдағы (бірдей температурада және қысымда) әр түрлі газдардың бірдей көлемдеріндегі молекулалар саны бірдей болады.
Авогадро заңынан мынадай салдар шығады: бірдей жағдайда молекулалар саны бірдей болатын әр түрлі газдар бірдей көлем алады әр түрлі газдар молекулалары мөлшерлерінің бір-бірінен үлкен айырмасы болса да (мысалы, Н2 мен С5Н12) бірдей сандары неге бірдей көлем алады? Оның себебі, кәдімгі температурада және қысымда газдар молекулаларының арақашықтығы молекулалардың мөлшерінен көптеген есе үлкен болады. Сондықтан газдар көлемі бірдей жағдайда молекулалардың мөлшеріне емес, олардың ара қашықтығына ғана байланысты болады.
Газдардың қысымын арттырып, температурасын өте төмендеткенде олардың молекулалары бір-біріне шегіне жете жақындасады. Мұндай жағдайларда газдар сұйық немесе қатты күйге айналуы мүмкін. Бұл сұйық немесе қатты заттардың көлемдері молекулалардың өздерінің алатын көлемдеріне байланысты болады.
Сондықтан да Авогадро заңы заттардың сұйық және қатты күйлері үшін қолданылмайды. Басқа газ заңдары сияқты Авогадро заңы идеал газдар мен төменгі қысымдағы және жоғары температурадағы реал газдар үшін қолданылады.
Авогадро заңынан өте маңызды салдар шығады: барлық заттардың 1 моліндегі молекулалар саны бірдей, олай болса әр түрлі газдардың 1 моліндегі молекулалар саны бірдей болғандықтан олар бірдей жағдайда бірдей көлем алады.
Мысал ретінде әр түрлі газдардың қалыпты жағдайда (қысым 760 мм, температура 00С) алатын көлемін есептеп шығарайық. Тәжірибе бойынша қалыпты жағдайда 1л сутектің массасы 0,09 г, 1л оттектің массасы 1,43г, 1л азоттың массасы 1,25 г. Олардың сәйкес молекулалық массалары 2 м.а.б., 32 м.а.б., 28 м.а.б.
Аталған газдардың әрқайсысының молінің массасын бір литрінің массасына бөліп, қалыпты жағдайда олардың бірдей көлем (22,4 л) алатынын анықтаймыз:
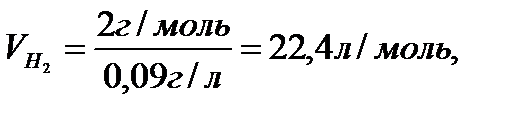
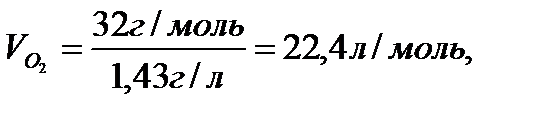
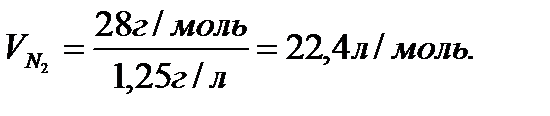
Сонымен, кез келген газдың 1 молі қалыпты жағдайда 22,4 л көлем алады. Бұл көлемді газдардың мольдік көлемі деп атайды, оның есептер шығаруда маңызы зор.
Эквиваленттер заңы Эквиваленттер түсінігі негізіндегі эквиваленттер заңы былай айтылады: заттардың өзара әрекеттесетін мөлшерлері олардың химиялық эквиваленттеріне тура пропоционал болады. Мұның мәнісі: заттар қалдықсыз әрекеттесу үшін олардың эквивалентті мөлшерлерін алу керек. Мысалы, сутек атомдарының 1г/молі натрийдің 23 г/молімен, сутек атомдарының 2 г/молі натрийдің 46 г/молімен әректтеседі.
Эквивалент заңын математикалық түрде былай өрнектеуге болады:
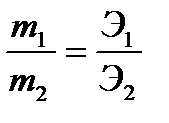
мұндағы т1 және т2 –заттардың массалары, г Э1 және Э2 – заттардың эквивалентттік массалары, г/моль.
Егер әрекеттесуші заттардың массалары және біреуінің эквиваленттік массасы белгілі болса, онда екіншісінің эквивалентін жоғарыда көрсетілген формула арқылы оңай табуға болады. Мысалы, 5 г металл ауада жанған кезде 9,44 г оксид түзілген. Металдың эквивалентін табу керек. Шешуі: металл ауада жанғанда оттегімен қосылады, яғни түзілген оксид құрамында 4,44 г оттек (9,44 – 5 = 4,44) болады. Енді эквивалент заңының формуласын пайдаланып металдың эквивалентін табамыз:
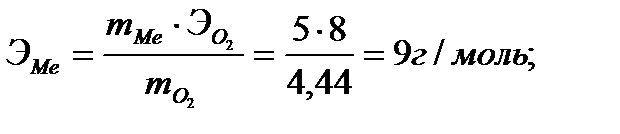
Заттардың эквиваленті жүретін реакцияға және оның түріне байланысты болады. Мысалы, ортофосфор қышқылымен натрий гидроксидінің арасындағы реакция әр түрлі жүруі мүмкін:
Н3РО4 + NaOH = NaH2PO4 + H2O
Бұл жерде 1 моль қышқыл 1 моль негізбен әрекеттеседі, демек эквиваленті ЭН3РО4 = 98/1 = 98, ал эквиваленттік массасы 98 г/моль.
Поиск по сайту: