 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тест тапсырмалары 21 страница
Òåìïåðàòóðàíûң òåïå-òåңäiêêå әñåði. Æүéåíiң òåìïåðàòóðàñûíàðòòûðғàíäà õèìèÿëûқ òåïå-òåңäiê æûëó ñiңiðå æүðåòií ðåàêöèÿíûң áàғûòûíà қàðàé ығûñàäû. Àììèàêтың òүçiëó ðåàêöèÿñû æûëóды øûғàðà æүðåòiíäiêòåí, яғни экзотермиялық реакция болғандықтан æүéåíiң òåìïåðàòóðàñûí àðòòûðғàíäà õèìèÿëûқ òåïå-òåңäiê àììèàêòûң àçîò ïåí ñóòåêêå ûäûðàó áàғûòûíà қàðàé ûғûñàäû, àë áұë æàғäàé òåìïåðàòóðàíûң æîғàðûëàóûíà қàðñû әñåð åòåäi. Æүéåíiң òåìïåðàòóðàñûí òөìåíäåòêåíäå òåïå-òåңäiê æûëó áөëå æүðåòií ðåàêöèÿíûң áàғûòûíà қàðàé, ÿғíè àììèàêòûң òүçiëó áàғûòûíà қàðàé ûғûñàäû, àë ìұíûң өçi òåìïåðàòóðàíûң òөìåíäåóiíå қàðñû әñåð åòåäi.
Қûñûìíûң òåïå-òåңäiêêå әñåði. Ãàç òәðiçäi çàòòàð áið-áiðiìåí әðåêåòòåñêåíäå қûñûìíûң ìàңûçû çîð. Қûñûìäû êүøåéòóäiң íәòèæåñiíäå áåëãiëi êөëåìäåãi ðåàêöèÿëàñóøû çàòòàðäûң êîíöåíòðàöèÿëàðû өñåòiíäiêòåí ðåàêöèÿíûң æûëäàìäûғû äà àðòàäû.
Àììèàê òүçiëó ðåàêöèÿñûíäà ðåàêöèÿғà қàòûñàòûí бастапқы çàòòàðäûң ìîëüäiê êîíöåíòðàöèÿñû аммиактың мольдік концентрациясынан åêi åñå êөï. Áұäàí ðåàêöèÿғà қàòûñàòûí çàòòàðäûң êөëåìäåðiíiң қîñûíäûñû ðåàêöèÿ íәòèæåñiíäå òүçiëåòií çàòòûң êөëåìiíåí åêi åñå êөï åêåíi êөðiíåäi. Åãåð îñû æүéåíiң қûñûìûí êөáåéòñå, ðåàêöèÿғà түсеòií çàòòàðäûң êîíöåíòðàöèÿñû ðåàêöèÿ íәòèæåñiíäå àëûíàòûí çàòòûң êîíöåíòðàöèÿñûíàí êөáiðåê өñåòiíäiêòåí õèìèÿëûқ òåïå-òåңäiê àììèàê òүçiëó æàғûíà қàðàé àóûñàäû.
Ñîíûìåí, æүéåíiң қûñûìûí êүøåéòêåíäå õèìèÿëûқ òåïå-òåңäiê êөëåìi àç çàòòàð òүçiëåòií ðåàêöèÿíûң áàғûòûíà қàðаé ûғûñàäû. Áұë æàғäàé æүéå қûñûìûíûң òөìåíäåóiíå æàғäàé æàñàéäû, ÿғíè ñûðòқû æàғäàéäûң өçãåðóiíå қàðñû әñåð åòåäi.
Æүéåíiң қûñûìûí òөìåíäåòêåíäå õèìèÿëûқ òåïå-òåңäiê êөëåìi êөáiðåê çàòòàð òүçiëåòií ðåàêöèÿ áàғûòûíà қàðàé, ÿғíè, àììèàêòûң àçîòïåí ñóòåêêå ûäûðàó áàғûòûíà қàðàé ûғûñàäû. Áұë æàғäàé қûñûìäû æîғàðûëàòûï, ñûðòқû өçãåðiñêå қàðàìà-қàðñû áàғûòòà әñåð åòåäi.
Æүéåäåãi ðåàêöèÿғà қàòûñқàí çàòòàð êөëåìäåði ìåí ðåàêöèÿ íәòèæåñiíäå òүçiëãåí çàòòàðäûң êөëåìäåði өçàðà òåң áîëñà, қûñûìíûң өçãåðói ðåàêöèÿíûң òåïå-òåңäiãiíå әñåð åòïåéäi. Ìûñàëû, àçîò (II) îêñèäií ñèíòåçäåó ðåàêöèÿñûíäà
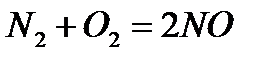
ðåàêöèÿғà åêi êөëåì çàò қàòûñàäû äà, ðåàêöèÿ íәòèæåñiíäå åêi êөëåì çàò òүçiëåäi. Áұë æàғäàéäà қûñûìäû қàëàé өçãåðòñå äå õèìèÿëûқ òåïå-òåңäiê áұçûëìàéäû. Õèìèÿ өíäiðiñiíäå êөïòåãåí õèìèÿëûқ çàòòàð àëó үøií Ëå-Øàòåëüå ïðèíöèïi êåңiíåí қîëäàíûëàäû.
Ëå-Øàòåëüå ïðèíöèïií ãåòåðîãåíäiê ðåàêöèÿëàðғà äà ïàéäàëàíóғà áîëàäû. Ìûñàë ðåòiíäå êөìiðòåê (IV) îêñèäiíiң êөìіðòåê (қàòòû çàò) àðқûëû òîòûқñûçäàíó ðåàêöèÿñûí êåëòiðåéiê:
ÑÎ2 + Ñ = 2ÑÎ DÍ= +172,4 êÄæ
Áұë ðåàêöèÿ æûëó ñiңiðå æүðåòiíäiêòåí òåìïåðàòóðàíû æîғàðûëàòқàíäà òåïå-òåңäiê êөìiðòåê (II) îêñèäi òүçiëåòií æàққà қàðàé ûғûñàäû, àë ñàëқûíäàòқàíäà êөìiðòåê (IV) îêñèäi мен көміртек òүçiëåòií áàғûòқà қàðàé ығûñàäû.
Қûñûìäû êүøåéòêåíäå õèìèÿëûқ òåïå-òåңäiê êөëåìi àç çàòòàð òүçiëåòií ðåàêöèÿíûң áàғûòûíà қàðàé, ÿғíè êөìiðòåê (IV) îêñèäi òүçiëåòií áàғûòқà қàðàé ûғûñàäû. Æүéåíiң қûñûìûí àçàéòóäûң íәòèæåñiíäå õèìèÿëûқ òåïå-òåңäiêòi êөìiðòåê (II) îêñèäi òүçiëåòiíò óðà ðåàêöèÿíûң áàғûòûíà қàðàé ûғûñòûðóғà áîëàäû.
Õèìèÿëûқ òåïå-òåңäiêòiң ығûñóûíà æүéåäåãi ãàçäàðäûң êîíöåíòðàöèÿñû ғàíà әñåð åòåäi. Êөìiðòåêòiң êîíöåíòðàöèÿñûí өçãåðòó æүéåíiң òåïå-òåңäiê қàëïûíà әñåð åòïåéäi.
4. Бақылау сұрақтары:
1. Қайтымды реакция дегеніміз не?
2. Химиялық тепе-теңдік қандай жағдайда орнығады?
3. Тепе-теңдік константасы қалай анықталады?
4. Химиялық реакцияның ығысуына температураның, қысымның, бастапқы заттардың концентрациясының жоғарылауы қалай әсер етеді?
5. Тест тапсырмалары:
1. Қандай реакцияны қайтымсыз реакция деп атайды?
1) тура реакция жылдамдығы кері реакция жылдамдығына тең болатын реакцияны
2) реакция өнімдері бір-бірімен әрекеттесетін реакцияны
3) бір мезгілде екі бағытта жүретін реакцияны
4) бастапқы заттарды түзетін реакцияны
5) реакция өнімдері бір-бірімен әрекеттеспейтін реакцияны
2. Қайтымды реакцияға қысқаша анықтама беріңіз:
1) тек бір бағытта жүретін реакция
2) реакция өнімдері бір-бірімен әрекеттеспейтін реакция
3) реакция өнімдері бір-бірімен әрекеттесетін реакция
4) нәтижесінде тұнба түзілетін реакция
5) газ немесе су бөле жүретін реакция
3. Химиялық тепе-теңдік дегеніміз не?
1) жылдамдықтары бойынша айырмашылықтары болатын реакцияның күйі
2) реакция өнімдері бір-бірімен әрекеттесетін кездегі реакцияның күйі
3) тура және кері бағытта жүретін реакциялардың күйі
4) бір мезгілде екі бағытта жүретін реакциялардың жылдамдықтары теңескен кездегі реакциялар күйі
5) жылдамдықтары бойынша айырмашылықтары болмайтын реакцияның күйі
4. Қандай реакция қайтымды реакцияға жатады?
1) К2СО3 + 2НСl = 2KCl + H2O + CO2
2) H2 + I2 = 2HI
3) Na2SO4 + BaCl2 = 2NaCl + BaSO4
4) Ca + Cl2 = CaCl2
5) H2SO4 + Zn = ZnSO4 + H2
5. Қайтымсыз реакцияны көрсетіңіз:
1) H2 + I2 = 2HI
2) 2KClO3 = 2KCl + 3O2
3) 3Н2 + N2 = 2NН3
4) O2 + N2 = 2NO
5) NH4Cl = NH3 + HCl
6. Ле-Шателье принципінің анықтамасы:
1) Тепе-теңдік күйде тұрған жүйеге сырттан әсер еткенде тура және кері реакциялардың жылдамдықтары өзгереді
2) Тепе-теңдік күйде тұрған жүйеге сырттан әсер еткенде тепе-теңдік бұзылады
3) Тепе-теңдік күйде тұрған жүйеге сырттан әсер еткенде осы әсерді ұлғайтатын реакция жүреді
4) Тепе-теңдік күйде тұрған жүйеге сырттан әсер еткенде тепе-теңдік бұзылады және кері реакция жүреді
5) Тепе-теңдік күйде тұрған жүйеге сырттан әсер еткенде осы әсерді азайтатын реакция жүреді
7. Берілген FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl реакцияның тепе-теңдік күйіне әсер етпейтін фактор:
1) калий роданидінің массалық үлесі
2) темір хлоридінің концентрациясы
3) калий хлоридінің мөлшері
4) қысым
5) энтропия
8. Реакция өнімінің шығымы қандай жағдайда жоғары болады?
1) Кт/т << 1
2) Кт/т >> 1
3) Кт/т = 1
4) К1 > K2
5) К1 < K2
9. Қайтымды реакцияларда химиялық тепе-теңдіктің ығысуын зерттеген ғалым:
1) Аррениус
2) Рауль
3) Резерфорд
4) Авогадро
5) Ле-Шателье
10. Берілген FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl реакцияда калий хлоридінің концентрациясын азайтқанда қандай реакция жүреді?
1) бастапқы заттардың түзілу реакциясы
2) кері реакция
3) тура реакция
4) калий роданидінің түзілу реакциясы
5) реакция екі бағытта жүреді
11. 3Н2 + N2 = 2NН3 (ΔН = - 92 kДж) берілген жүйеде температураны жоғарылатқанда қандай реакция жүреді?
1) аммиактың ыдырау реакциясы
2) аммиактың түзілу реакциясы
3) тура реакция
4) қайтымды реакция
5) қайтымсыз реакция
12. 3Н2 + N2 = 2NН3 реакциясында қысым жоғарылағанда қай реакция жүреді?
1) реакция өнімінің ыдырау реакциясы
2) реакция өнімінің түзілу реакциясы
3) кері реакция
4) қайтымды реакция
5) қайтымсыз реакция
13. СО(г) + Н2О(г) = CO2(г)+ Н2(г) (ΔН = - 42,6 kДж) реакциясында тепе-теңдіктің ығысуына не әсер етпейді?
1) қысым
2) концентрацияның артуы
3) температураның өсуі
4) концентрацияның кемуі
5) температураның төмендеуі
14. СО(г) + Н2О(г) = CO2(г)+ Н2(г) (ΔН = - 42,6 kДж) реакциясында көміртек (II) оксидінің концентрациясын арттырғанда тепе-теңдік қалай ығысады?
1) тепе-теңдік ығыспайды
2) бастапқы заттар жағына қарай
3) кері реакция жағына қарай
4) реакция өнімдерінің түзілу жағына қарай
5) қысымның өсу жағына қарай
15. СО(г) + Н2О(г) = CO2(г)+ Н2(г) реакциясы үшін тепе-теңдік тұрақтысының өрнегін көрсетіңіз:
1) 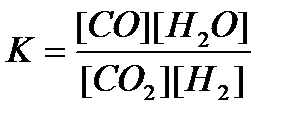
2) 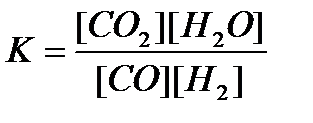
3) 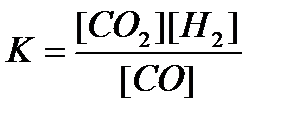
4) 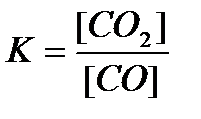
5) 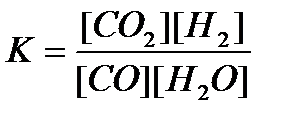
16. Химиялық тепе-теңдік тұрақтысы неге тәуелді болады?
1) заттың табиғаты мен температураға
2) көлем мен температураға
3) заттың концентрациясы мен температураға
4) заттың табиғаты мен көлеміне
5) тек температураға
17. Тепе-теңдік тұрақтысының мәні қандай болғанда реакция бастапқы заттардың түзілу жағына қарай ығысады?
1) Кт/т >> 1
2) Кт/т << 1
3) Кт/т = 1
4) К1 > K2
5) К1 < K2
18. Тура және кері реакциялардың жүру мүмкіндігі Кт/т -ң қандай мәнінде бірдей болады?
1) К1 < K2
2) Кт/т >> 1
3) Кт/т << 1
4) К1 > K2
5) Кт/т = 1
19. СО(г) + Н2О(г) = CO2(г) + Н2(г) + 42,6 kДж реакциясында температураны арттырғанда тепе-теңдік қалай ығысады?
1) әсер етпейді
2) солдан оңға
3) оңнан солға
4) өнімнің түзілу жағына қарай
5) бастапқы заттың концентрациясы азаятын жаққа қарай
20. СО(г) + Н2О(г) = CO2(г) + Н2(г) + 42,6 kДж реакциясында температураны төмендеткенде тепе-теңдік қалай ығысады?
1) оңнан солға
2) солдан оңға
3) әсер етпейді
4) кері реакция жағына қарай
5) өнімнің концентрациясы азаятын жаққа қарай
21. СО(г) + Н2О(г) = CO2(г) + Н2(г) + 42,6 kДж реакциясында тепе-теңдікті солдан оңға қалай ығыстыру үшін не істеу керек?
1) сутектің көлемін арттыру керек
2) судың мөлшерін кеміту керек
3) температураны көтеру керек
4) көміртек (II) концентрациясын арттыру керек
5) көмір қышқыл газдың концентрациясын көбейту керек
22. Жүйенің қысымын арттырғанда тепе-теңдік қалай ығысады?
1) кері реакция жағына қарай
2) көлемі артатын заттар түзілетін жаққа қарай
3) тура реакция жағына қарай
4) көлемі азаятын заттар түзілетін жаққа қарай
5) солдан оңға қарай
23. Эндотермиялық қайтымды реакцияда тепе-теңдікті реакция өнімінің түзілу жағына қарай ығыстыру үшін не істеу керек?
1) температураны арттыру керек
2) температураны кеміту керек
3) қысымды көбейту керек
4) қысымды азайту керек
5) өнімнің концентрациясын көбейту керек
24. Экзотермиялық қайтымды реакцияда тепе-теңдікті реакция өнімінің түзілу жағына қарай ығыстыру үшін не істеу керек?
1) өнімнің концентрациясын көбейту керек
2) температураны арттыру керек
3) қысымды көбейту керек
4) қысымды азайту керек
5) температураны кеміту керек
25. Қандай жағдайда қысым тепе-теңдіктің ығысуына әсер етпейді?
1) реакция өнімдерінің көлемдері бір-біріне тең болғанда
2) бастапқы заттың көлемі реакция өнімінің көлемінен көп болғанда
Поиск по сайту: