 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тест тапсырмалары 2 страница
Егер әрекеттесу әрі қарай жүрсе:
Н3РО4 + 2NaOH = Na2HPO4 + H2O
Мұнда 1 моль қышқыл 2 моль негізбен әрекеттеседі. Оның эквиваленті ЭН3РО4 = 98/2 = 49, ал эквиваленттік массасы 49 г/моль болады.
Яғни, заттың эквивалентін анықтау үшін химиялық реакция теңдеуін құрып, оның молекулалық массасын әрекеттесуші заттың эквивалент санына бөлу керек.
Эквиваленттер заңы атом-молекулалық ілімге сәйкес келеді. Кез келген элементтің бір атомы басқа бір элементтің белгілі атом сандарымен қосылатындықтан, әрі әрбір атомның массасы тұрақты болғандықтан, олардың реакцияға қатысатын массалық мөлшерлері де тұрақты, эквивалентті болады.
Атом-молекулалық ілім
Атом-молекулалық ілім з аттардың және олардың бір түрден екінші түрге айналуын түсінуге мүмкіндік береді.
Дүниедегі барлық заттардың атомдардан тұратындығын біздің жыл санауымызға дейінгі ІV ғасырда өмір сүрген грек философы Демокрит айтқан болатын. Бұл ойшылдың түсінігі бойынша заттар бір-бірінен өздерін құрайтын атомдардың саны, пішіні бойынша және орналасу ретімен ажыратылады. Ол бүкіл әлемдегі болып жататын құбылыстарды атомдардың өзара қосылуы және айырылуымен түсіндірді. Бірақ, бұл түсініктер тәжірибе арқылы дәлелденбеген жалпы философиялық жорамалдар еді.
Ертедегі грек философтарының атом туралы түсініктерін М.В. Ломоносов дамытып жүйелі атом-молекулалық ілімге айналдырды. Бұл ілімнің негізі мына қағидалардан тұрады:
1. Барлық заттар үнемі қозғалыста болатын «корпускулалардан» (молекулалардан) тұрады. Молекулалар «элементтерден» (атомдардан) тұрады. Атомдар үнемі қозғалыста болады. Әрбір атомның өзіне тән қасиеті, мөлшері және массасы болады.
2. Жай заттардың молекулалары бірдей атомдардан, ал күрделі заттардың молекулалары әр түрлі атомдардан тұрады.
3. Молекулалардың қасиеттері олардың құрамына кіретін атомдардың түрлері мен санына ғана емес, сонымен қатар, атомдардың, молекулалардың орналасу ретіне де байланысты болады.
4. Бақылау сұрақтары:
1. Салыстырмалы атомдық және молекулалық масса дегеніміз не?
2. Молярлық масса қалай анықталады?
3. Валенттілік дегеніміз не?
4. Химияның негізгі стехиометриялық заңдарын атаңыздар
5. Атом-молекулалық ілімнің негізгі ережелері.
Тест тапсырмалары
1. Cутектің 3,01·1023 молекуласының мольдік мөлшері қанша?
1) 0,2 моль
2) 1,0 моль
3) 0,5 моль
4) 0,05 моль
5) 2,0 моль
2. Көмір қышқыл газдың сутегі бойынша тығыздығы нешеге тең?
1) 5,5
2) 44
3) 5,0
4) 22
5) 12
3. Көмір қышқыл газдың ауа бойынша тығыздығы қанша?
1) 2,0
2) 1,5
3) 3,0
4) 3,3
5) 2,2
4. 49 г күкірт қышқылының зат мөлшерін анықтаңыз:
1) 1.0 моль
2) 0.5 моль
3) 2 моль
4) 1.5 моль
5) 3.0 моль.
5. Cутегі бойынша тығыздығы 22-ге тең газдың молярлық массасы қанша?
1) 44 г/моль
2) 32 г/моль
3) 56 г/моль
4) 45 г/моль
5) 40 г/моль
6. Хлор бойынша тығыздығы 0,62-ге тең газдың молярлық массасын анықтаңыз:
1) 44 г/моль
2) 60 г/моль
3) 50 г/моль
4) 55 г/моль
5) 40 г/моль.
7. Қалыпты жағдайда белгісіз газдың 19,6 г 10 л көлем алады. Осы газдың молярлық массасы нешеге тең?
1) 30 г/моль
2) 40 г/моль
3) 45 г/моль
4) 33 г/моль
5) 44 г/моль
8. 31 г фосфорды жағу үшін оттектің қандай көлемі жұмсалады?
1) 28 л
2) 40 л
3) 30 л
4) 45 л
5) 60 л
9. Азоттың 2 молі (қ.ж.) қандай көлем алады?
1) 15 л
2) 22,4 л
3) 67,2 л
4) 5,6 л
5) 44,8 л
10. 32 г оттек (қ.ж.) қандай көлем алады?
1) 55 л
2) 22,4 л
3) 67 л
4) 5,6 л
5) 44,8 л
11. 8 г сутек жанғанда оттегінің қанша көлемі жұмсалады?
1) 22,4 л
2) 24,8 л
3) 20 л
4) 20,2 л
5) 18 л
12. 2 моль тұз қышқылының массасы нешеге тең?
1) 35,5 г
2) 65 г
3) 73 г
4) 40 г
5) 45 г
13. 56 г азоттың зат мөлшерін анықтаңыз:
1) 3,0 моль
2) 1 моль
3) 2,0 моль
4) 0,5 моль
5) 1,5 моль.
14. Судың қандай массасында 30,1·1023 молекуласы болады?
1) 90 г
2) 80 г
3) 18 г
4) 180 г
5) 71 г
15. Молярлық массаның өлшем бірлігі қандай?
1) моль-1
2) г/л
3) г
4) г/моль
5) м.а.б.
16. Заттың 3 молінің массасы 51 г. Осы заттың молярлық массасын анықтаңыз:
1) 25 г/моль
2) 20 г/моль
3) 17 г/моль
4) 15 г/моль
5) 14 г/моль.
17. Қалыпты жағдайда 0,25 моль оттектен және 0,25 моль азоттан тұратын қоспа қандай көлем алады?
1) 11,2 л
2) 22,4 л
3) 5,6 л
4) 33,6 л
5) 44,8 л
18. Оттек молекуласының 0,5 моліндегі атомдар санын есептеңіз:
1) 3,01·1023
2) 6,02·1023
3) 9,03·1023
4) 0,301·1023
5) 15,05·1023
19. Авогадро тұрақтысы нені көрсетеді?
1) зат мөлшерін
2) заттың мольдік массасын
3) молекула санын
4) атом санын
5) заттың 1 моліндегі құрылымдық бөлшектердің санын
20. 2,5 моль магнийдің массасы нешеге тең?
1) 55 г
2) 60 г
3) 58 г
4) 50 г
5) 46 г
21. Эквивалент заңының математикалық өрнегін көрсетіңіз:
1) Э1/Э2 = m2/m1
2) Э1/Э2 = m1/m2
3) Э2/Э1 = m1/М2
4) P = Vρ
5) υ = m/M
22. Қалыпты жағдайда оттектің бір эквивалентінің массасы неше грамм болады?
1) 2 г
2) 16 г
3) 32 г
4) 4 г
5) 8 г
23. Қалыпты жағдайда оттектің бір эквивалентінің массасы қандай көлем алады?
1) 22,8 л
2) 4 л
3) 5,6 л
4) 14,2 л
5) 7,6 л
24. Судың құрамындағы сутектің массалық үлесін анықтаңыз:
1) 88,89 %
2) 22,22 %
3) 18 %
4) 11,11 %
5) 52,52 %
25. Күкірт қышқылының эквивалентін анықтаңыз:
1) 49
2) 55
3) 43
4) 25
5) 30
26. Қышқылдың эквивалентін қай формуламен анықтайды?
1) Э = М/n·H+
2) Э = М/n·ОН ־
3) Э = М/n·В
4) Э = А/В
5) Э = А/ВС
27. Алюминий оксидіндегі алюминийдің эквивалентін анықтаңыз:
1) 6
2) 27
3) 54
4) 3
5) 9
28. NaOH + H2SO4 = NaHSO4 + H2O теңдеуіндегі күкірт қышқылының эквиваленті нешеге тең болады?
1) 49
2) 98
3) 24,5
4) 64
5) 40
29. 2NaOH + H2SO4 = Na2SO4 + 2H2O теңдеуіндегі күкірт қышқылының эквиваленті нешеге тең болады?
1) 64
2) 98
3) 24,5
4) 49
5) 40
30. Зат мөлшерін қандай формуламен анықтайды?
1) m1/m2 = Э1/Э2
2) m = υ·М
3) υ = m/M
4) V = m/Т
5) Т = m/M
№ 2 дәріс. Бейорганикалық қосылыстардың негізгі кластары
1. Дәрістің мақсаты:
Бейорганикалық қосылыстардың негізгі кластары мен олардың химиялық қаситеттері бойынша студенттердің білімдерін терендету.
2. Дәрістің жоспары:
1. Оксидтердің жіктелуі және химиялық қасиеттері
2. Қышқылдардың жіктелуі және химиялық қасиеттері
3. Негіздердің жіктелуі және химиялық қасиеттері
4. Тұздардың жіктелуі және химиялық қасиеттері
5. Бейорганикалық қосылыстардың негізгі кластарының арасындағы генетикалық байланыс
3. Дәрістің мазмұны:
Барлық белгілі таза заттар жай және күрделі болып бөлінеді. Жай заттар металдар мен бейметалдарға жіктеледі. Қазіргі кезде белгілі болып отырған 116 химиялық элементтердің барлығы 3 000 000 артық қосылыстар түзеді, оның ішінде 300 000 бейорганикалық қосылыстарға жатады. Әрбір қосылыстың өзіне тән ерекше қасиеттері болады, сонымен қатар, көптеген химиялық қосылыстарда ортақ, бір-біріне ұқсас жалпы қасиеттер болады. Осы ортақ қасиеттерін негізге ала отырып бейорганикалық қосылыстарды оксидтер, қышқылдар, негіздер, тұздар кластарына бөледі.
Оксидтердің жіктелуі және химиялық қасиеттері
Оксидтер дегеніміз екі элементтің атомдарынан тұратын, оның біреуі оттек болатын күрделі заттар.
Оксидтердің аттары. Халықаралық номенклатура бойынша элементтердің оттекпен қосылыстарын оксидтер деп атайды. Егер оксид түзетін элемент әр түрлі валенттілік көрсететін болса, онда оксидтегі элементтің атынан кейін жақша ішіне рим саны арқылы валенттілігі көрсетіледі. Мысалы, темір (II) оксиді 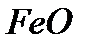 , темір (III) оксиді
, темір (III) оксиді 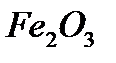 .
.
Барлық оксидтер тұз түзетін және тұз түзбейтін болып екі топқа бөлінеді.
Тұз түзбейтін оксидтеркөп емес. Олар - 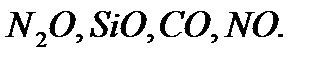 Бұл оксидтер химиялық қосылыстармен тікелей әрекеттесіп тұз түзбейді. Химиялық қосылыстармен тікелей әрекеттесіп тұз түзетін оксидтерді тұз түзуші оксидтер деп атайды. Мысалы, темір (III) оксиді
Бұл оксидтер химиялық қосылыстармен тікелей әрекеттесіп тұз түзбейді. Химиялық қосылыстармен тікелей әрекеттесіп тұз түзетін оксидтерді тұз түзуші оксидтер деп атайды. Мысалы, темір (III) оксиді 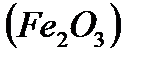 тұз түзетін оксид, өйткені ол қышқылмен әрекеттесіп тұз түзе алады.
тұз түзетін оксид, өйткені ол қышқылмен әрекеттесіп тұз түзе алады.
Негіздік оксидтер. Сумен әрекеттескенде негіздер түзетін немесе қышқылдармен әрекеттесіп тұздар түзетін оксидтерді негіздік оксидтер деп атайды. Мысалы, 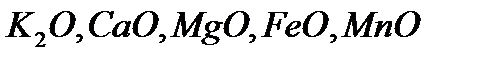 негіздік оксидтерге жатады.
негіздік оксидтерге жатады.
Төменде негіздік оксидтердің сумен әрекеттесу реакцияларының теңдеулері берілген:
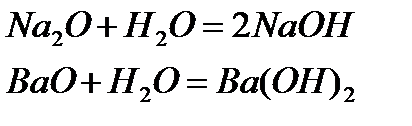
Кейбір негіздік оксидтер сумен тікелей әрекеттеспейді. Мыс (II) оксиді
негіздік оксидке жатады, бірақ ол сумен әрекеттеспейді, оны мыс оксидін қыздырып алуға болады:
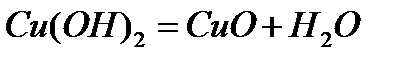
Бұл реакция CuO оксидінің негіздік оксид екенін, оның гидраты Cu(OН)2 негіз екенін көрсетеді. Негіздік оксидтер қышқылдармен әрекеттесіп тұздар түзеді. Мысалы,
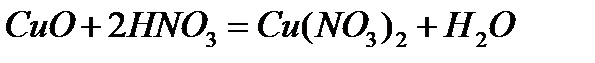
Қышқылдық оксидтер. Қышқылдық оксидтер дегеніміз сумен әрекеттесуінен түзілген гидраттары қышқыл болып келетін оксидтер:
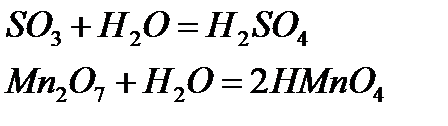
Кейбір қышқылдық оксидтер сумен тікелей әрекеттеспейді. Оларға сәйкес келетін қышқылдарды жанама жолмен алады, ал суда ерімейтін қышқылдық оксидті оған сәйкес келетін қышқылды қыздыру арқылы алады:
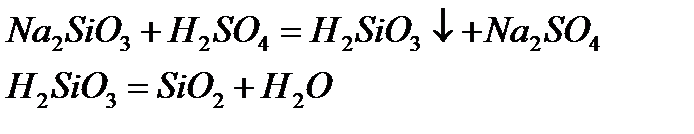
Қышқылдық оксидтер негіздермен, негіздік оксидтермен әрекеттесіп тұздар түзеді:
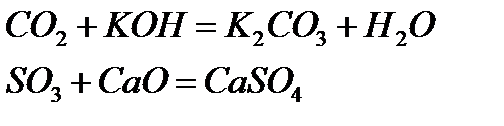
Қышқылдық оксидтерге негізінен бейметалдардың оксидтері, сонымен қатар, көптеген жоғарғы оң тотығу дәрежесін көрсететін металдардың оксидтері 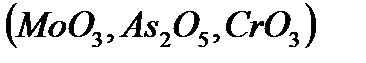 жатады.
жатады.
Амфотерлік оксидтер. Амфотерлік деп реакцияның жүру жағдайына байланысты әрі қышқылдық, әрі негіздік оксидтердің қасиеттерін көрсететін немесе қышқылдармен де, негіздермен де әрекеттесетін оксидтерді айтады. Амфотерлік оксидтерге 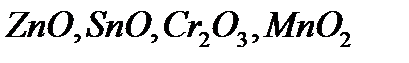 жатады.
жатады.
Мысалы, алюминий оксидінің амфотерлік қасиеті оның әрі қышқылмен, әрі негізбен әрекеттесуінен көрінеді:
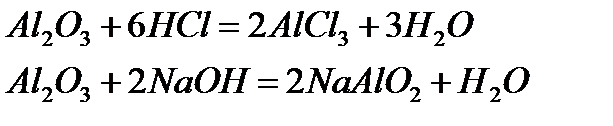
Оксидтерді алу тәсілдері.
1. Көптеген жай заттар оттекпен тікелей әрекеттесіп оксидтер түзеді. Мысалы,
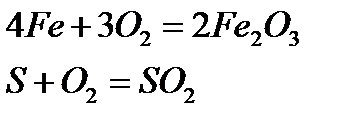
2. Негіздер мен қышқылдарды қыздырып ыдырату арқылы алу:
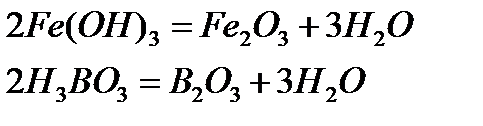
3. Орта, қышқыл және негіздік тұздарды қыздырып ыдырату арқылы алу:
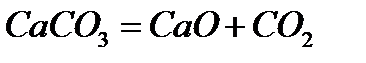
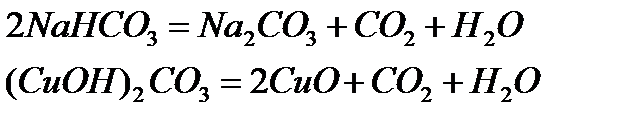
4. Тотықтырғыш қышқылдардың металдармен және бейметалдармен әрекеттесуі арқылы алу:
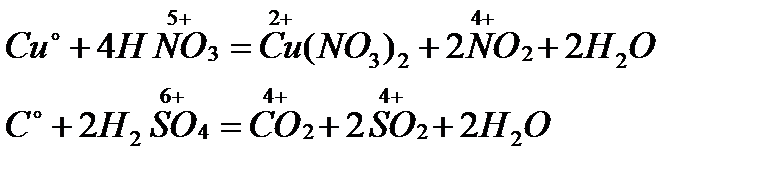
5. Әр түрлі органикалық заттардың жануы:
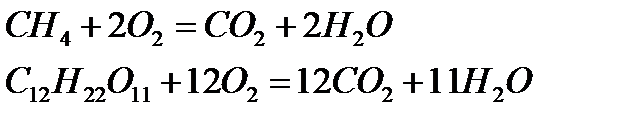
Қûøқûëäàðдың жіктелуі æәíå õèìèÿëûқ қàñèåòòåði
Қûøқûлдàð äåãåíiìiç ñóäàғû åðiòiíäiëåðiíäå ñóòåê êàòèîíäàðû ìåí қûøқûë қàëäûғûíûң àíèîíäàðûíà ûäûðàéòûí ýëåêòðîëèòòåð.
Áàðëûқ қûøқûëäàðғà òәí қàñèåòòåð – қûøқûëäûқ äәìі, êөê ëàêìóñòû қûçàðòóы, белсенді ìåòàëäàðìåí æәíå íåãiçäåðìåí әðåêåòòåñуі–қûøқûëäàðäûң åðiòiíäiäå ñóòåê èîíдарûí 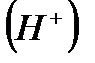 òүçóiíå áàéëàíûñòû болады.
òүçóiíå áàéëàíûñòû болады.
Қûøқûëäàð құðàìûíäàғы îòòåêòiң áîëóы немесе áîëìàóûíà қàðàé îòòåêñiç æәíå îòòåêòi қûøқûëäàð áîëûï áөëiíåäi. Îòòåêñiç қûøқûëäàðäûң құðàìûíäà îòòåê áîëìàéäû. Îëàðғà 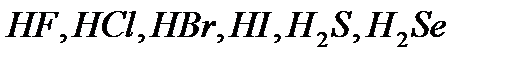 ò.á. æàòàäû. Îòòåêñiç қûøқûëäàðäûң àòòàðû îëàðäûң ñóòåêòi қîñûëûñòàðûíûң àòûíà қûøқûë äåãåí ñөç қîñûëûï àéòûëàäû, ìûñàëû,
ò.á. æàòàäû. Îòòåêñiç қûøқûëäàðäûң àòòàðû îëàðäûң ñóòåêòi қîñûëûñòàðûíûң àòûíà қûøқûë äåãåí ñөç қîñûëûï àéòûëàäû, ìûñàëû, 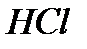 -õëîðñóòåê, àë îíûң ñóäàғû åðiòiíäiñi õëîðñóòåê қûøқûëû,
-õëîðñóòåê, àë îíûң ñóäàғû åðiòiíäiñi õëîðñóòåê қûøқûëû, 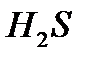 -êүêiðòñóòåê, àë îíûң åðiòiíäiñi êүêiðòñóòåê қûøқûëû.
-êүêiðòñóòåê, àë îíûң åðiòiíäiñi êүêiðòñóòåê қûøқûëû.
Құðàìûíäà îòòåê àòîìäàðû áàð қûøқûëäàðäû îòòåêòi қûøқûëäàð äåéäi. Ìûñàëû, 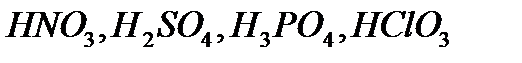 ò.á. îòòåêòi қûøқûëäàðғà æàòàäû.
ò.á. îòòåêòi қûøқûëäàðғà æàòàäû.
Құðàìûíäà ìåòàëғà àëìàñà àëàòûí ñóòåêòiң ñàíûíà қàðàé қûøқûëäàðäû áið íåãiçäi 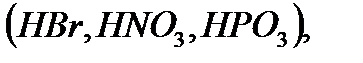 åêi íåãiçäi
åêi íåãiçäi 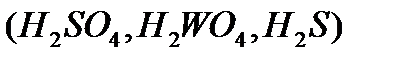 , үø íåãiçäi
, үø íåãiçäi 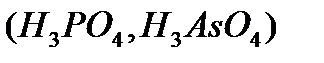 , òөðò íåãiçäi
, òөðò íåãiçäi 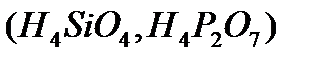 äåï áөëåäi. Áàñқàøà àéòқàäà қûøқûëäàðäûң íåãiçäiëiãi ñîë қûøқûë äèññîöèàöèÿëàíғàí êåçäå òүçiëåòií ñóòåê èîíäàðûíûң ñàíûìåí àíûқòàëàäû. Қûøқûë äèññîöèàöèÿëàíғàíäà ñóòåê êàòèîíäàðûìåí қàòàð қûøқûë қàëäûғûíûң àíèîíäàðû òүçiëåäi. Ìûñàëû, àçîò қûøқûëû áið, êүêiðò қûøқûëû åêi, ôîñôîð қûøқûëû үø íåãiçäi қûøқûëäàð:
äåï áөëåäi. Áàñқàøà àéòқàäà қûøқûëäàðäûң íåãiçäiëiãi ñîë қûøқûë äèññîöèàöèÿëàíғàí êåçäå òүçiëåòií ñóòåê èîíäàðûíûң ñàíûìåí àíûқòàëàäû. Қûøқûë äèññîöèàöèÿëàíғàíäà ñóòåê êàòèîíäàðûìåí қàòàð қûøқûë қàëäûғûíûң àíèîíäàðû òүçiëåäi. Ìûñàëû, àçîò қûøқûëû áið, êүêiðò қûøқûëû åêi, ôîñôîð қûøқûëû үø íåãiçäi қûøқûëäàð:
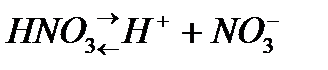
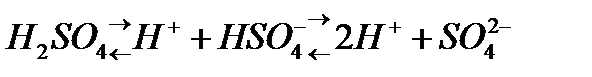
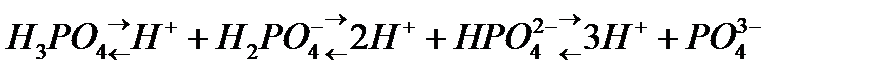
Қûøқûëäàðäûң àòòàðû. Åãåð қûøқûëäàðäûң құðàìûíäàғû îðòàëûқ àòîìíûң òîòûғó äәðåæåñi ïåðèîäòûқ æүéåäåãi өçi òұðғàí òîïòûң íөìiðiíå òåң áîëñà, îíäà қûøқûëäûң àòûí àòàó үøií ýëåìåíòòiң àòûíà «қûøқûëû» äåãåí ñөçäi қîñûï àéòàäû. Ìûñàëû, 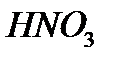 - àçîò қûøқûëû,
- àçîò қûøқûëû, 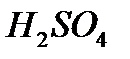 - êүêiðò қûøқûëû,
- êүêiðò қûøқûëû, 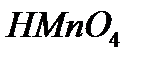 - ìàðãàíåö қûøқûëû ò.á.
- ìàðãàíåö қûøқûëû ò.á.
Åãåð қûøқûëäàðäûң құðàìûíäàғû îðòàëûқ àòîìíың» òîòûғó äәðåæåñi ïåðèîäòûқ æүéåäåãi өçi òұðғàí òîïòûң íөìiðiíåí êåì áîëñà, îíäà қûøқûëäûң àòûí àòàó үøií ýëåìåíòòiң àòûíà «òi», «òû» æұðíàқòàðûí æàëғàï «қûøқûë» äåãåí ñөçäi қîñûï àéòàäû, ìûñàëû, 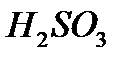 -êүêiðòòi қûøқûë,
-êүêiðòòi қûøқûë, 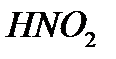 -àçîòòû қûøқûë,
-àçîòòû қûøқûë, 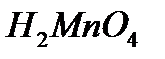 -ìàðãàíåöòi қûøқûë.
-ìàðãàíåöòi қûøқûë.
Поиск по сайту: