 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тест тапсырмалары 38 страница
4. Бақылау сұрақтары:
1. Қандай заттарды металдар деп атайды?
2. Металл атомдары құрылысының ерекшеліктерін және металдар арасындағы байланыстың химиялық табиғатын түсіндіріңіздер
3. Металдардың, жай заттардың электрөткізгіштік, жылуөткізгіштік және металдық жылтыры сияқты жалпы физикалық қасиеттерін қалай түсіндіруге болады?
4. Құйма дегеніміз не? Құрылысы бойынша қандай құймалар болады? Неліктен өндірісте таза металдарға қарағанда көбінесе құймаларды қолданады?
5. Неліктен темір шегені алюминий сымға қарағанда тез тат басады?
5. Тест тапсырмалары:
1. Қандай металдар қиын балқитын металдарға жатады?
1) 10000С – тан жоғары температурада балқитын металдар
2) 300 - 5000С температура аралығында балқитын металдар
3) 500 - 7000С температура аралығында балқитын металдар
4) 700 - 10000С температура аралығында балқитын металдар
5) 1000 – 20000С температура аралығында балқитын металдар
2. Балқу температурасы (t0балқу = 33700С) өте үлкен металл:
1) цезий
2) хром
3) натрий
4) вольфрам
5) марганец
3. Сұйық күйде болатын металл:
1) натрий
2) сынап
3) цезий
4) франций
5) осмий
4. Ең жеңіл металл
1) сутек
2) осмий
3) барий
4) литий
5) калий
5. Қандай металдар жеңіл металдарға жатады?
1) тығыздығы 5 г/см3 – ге тең
2) тығыздығы 5 г/см3- ден көп
3) тығыздығы 5 г/см3 – ден аз
4) тығыздығы 1 - 3 г/см3 аралығында болатын
5) тығыздығы 1 - 4 г/см3 аралығында болатын
6. Ең ауыр металл:
1) осмий
2) хром
3) темір
4) рений
5) полоний
7. Ең қатты металл:
1) платина
2) вольфрам
3) сынап
4) хром
5) висмут
8. Табиғатта тек қосылыс түрінде кездесетін металдар:
1) металдық жылтыры жоқ металдар
2) электрохимиялық кернеу қатарында сутектен кейін орналасқан металдар
3) электрохимиялық кернеу қатарында сутекке дейін орналасқан металдар
4) электродтық потенциалы оң мәнге ие болатын металдар
5) электродтық потенциалы нөлге тең болатын металдар
9 Табиғатта бос күйінде және қосылыс түрінде кездесетін металдар:
1) электродтық потенциалы нөлге тең болатын металдар
2) электрохимиялық кернеу қатарында сутекке дейін орналасқан металдар
3) металдық жылтыры бар металдар
4) электродтық потенциалы теріс мәнге ие болатын металдар
5) электрохимиялық кернеу қатарында сутектен кейін орналасқан металдар
10.Сумен әрекеттеспейтін металдар қатарын көрсетіңіз?
1) Ag, K, Au, Pt
2) Cu, Na, Ag, Hg
3) Cu, Ag, Au, Pt
4) K, Ca, Al, Cu
5) Li, Na, Ba, Hg
11. Ең созылғыш металл:
1) литий
2) натрий
3) алтын
4) марганец
5) алюминий
12. Ең төмен созылғыштық қасиет көрсететін металл:
1) вольфрам
2) марганец
3) мыс
4) натрий
5) күміс
13. Интерметалдық қосылыс дегеніміз не?
1) металдардың қатты ерітінділері
2) кез-келген қатынаста араласатын балқыған металдар
3) металл мен металдың әрекеттесіп түзетін химиялық қосылысы
4) металдың бейметалмен құймасы
5) біртекті құйма
14. Қатты ерітінді дегеніміз не?
1) бейметалл мен бейметалдың әрекеттесуі нәтижесінде пайда болатын зат
2) металл мен бейметал әрекеттескенде түзілетін қосылыс
3) металдардың болатпен араласып түзетін қосылысы
4) балқыған металдардың бір-бірімен кез-келген қатынаста араласатын түзетін біртекті құймасы
5) құймалар құрамына бейметалдың кіруі нәтижесінде түзілген қосылыс
15. Құймалар құрамында кездесетін бейметалдар қатарын көрсетіңіз:
1) С, Р, В, S, Si
2) C, Na, B, S, N
3) K, C, Si, S, P
4) S, Si, Ca, P, B
5) Si, B, P, C, Li
16. Коррозия дегеніміз не?
1)металдардың өздеріне ғана тән қасиеттерінің өзгеріп жарамсыз болып қалуы
2) металдардың тек қана ауадағы оттек әсерінен бұзылуы
3) тек қана металдардың сыртқы орта әсерінен жемірілуі
4) металдар мен құймалардың тек қана қышқылдар әсерінен бұзылуы
5) металдар мен құймалардың қоршаған ортаның әсерінен бүлінуі
17. Қоршаған орта әсерінен болатын коррозия қанша түрге бөлінеді?
1) 2
2) 3
3) 4
4) 5
5) 6
18. Коррозияның қандай түрі химиялық коррозияға жатады?
1) жүйеде электр тогы пайда болу арқылы жүретін коррозия
2) қышқылдардың металдармен әрекеттесуінің арқасында жүретін коррозия
3) электролит ерітінділерінің әсерінен болатын коррозия
4) электр тогын өткізетін сырқы орта әсерінен болатын коррозия
5) сілтілердің металдармен жанасуы салдарынан болатын коррозия
19. Қандай коррозия металдар мен құймалардың электрохимиялық коррозиясына жатады?
1) ауадағы құрғақ газдармен металдар мен құймалардың әрекеттесуінің нәтижесінде жүретін коррозия
2) металдар мен құймаларды термиялық өңдегенде пайда болатын коррозия
3) химиялық реакция нәтижесінде жүйеде электр тогы пайда болу арқылы жүретін коррозия
4) қоршаған ортадағы бейэлектролиттердің әсерінен болатын коррозия
5) құрғақ оттек, оксидтердің металдар және құймалармен әрекеттесуінен пайда болатын коррозия
20. Темірдің электрохимиялық коррозиялануы қай теңдеумен өрнектелген:
1) 4Fe + 3O2 → 2Fe2О3
2) 2Fe + O2 + 2H2O → 2Fe(OH)2
3) Fe + 2HCl → FeCl2 + H2
4) Fe2O3 + CO → 2FeO + CO2
5) 2FeSO4 = Fe2O3 + SO2↑ + SO3↑
21. Темірдің химиялық коррозиялану теңдеуін көрсетіңіз:
1) 4Fe + 3O2 → 2Fe2О3
2) 2Fe + O2 + 2H2O → 2Fe(OH)2
3) Fe + 2HCl → FeCl2 + H2
4) Fe2O3 + CO → 2FeO + CO2
5) 2FeSO4 = Fe2O3 + SO2↑ + SO3↑
22. Темірдің коррозиялануы кезінде анодта жүретін үрдіс:
1) 2Н+ + 2е-  → Н2
→ Н2
2) Fe0 - 2e- → Fe2+
3) 2H2O + O2 + 4е- → 4ОН-
4) O2 + 4Н+ + 4е- → 2H2O
5) Fe2+ + 2e- → Fe0
23. Бейтарап ортада темірдің толық жемірілуі нәтижесінде түзілетін қосылыс:
1) Fe(ОН)2
2) Fe(ОН)3
3) Fe2O3
4) FeO
5) Fe3O4
24. Металдарды коррозиядан қорғау үшін екі түрлі беттік қаптауды қолданады. Соларды атаңыз:
1) бейметалдық және электролиттік
2) металдық және электролиттік
3) металдық және бейметалдық
4) бейметалдық және бейэлектролиттік
5) инерттік және бейметалдық
25. Темірді мырышпен қаптау қандай қаптауға жатады?
1) бейэлектролиттік
2) бейметалдық
3) электролиттік
4) металдық
5) инерттік
26. Темірді лакпен сырлауды қандай қаптауға жатқызуға болады?
1) инерттік
2) металдық
3) электролиттік
4) бейэлектролиттік
5) бейметалдық
27. Протекторлық қорғау дегеніміз не?
1) металл бұйымдарының орнына полимерлі заттарды қолдану
2) электролит ерітіндісіне тежегіш қосу
3) электролит ортасындағы коррозиядан қорғайтын затқа белсенді металды қосу немесе жалғау
4) ортаны ауасыздандыру (деаэрациялау)
5) электролит ортасына ингибитор қосу
28. Ортаның құрамын өзгерту не үшін қолданылады?
1) металдарды электролиз әдісімен алу үшін
2) металдарды қышқыл әсерінен қорғау үшін
3) металдардың көшірмесін жасау үшін
4) металдың бетіне басқа металды қондыру үшін
5) интерметалдық қосылыстар алу үшін
29. Гальваностегия дегеніміз не?
1) интерметалдық қосылыстарды алу
2) электролиз көмегімен заттың металдық көшірмесін жасау
3) таза металл бұйымдарын алу
4) металл бұйымдарының бетін басқа металмен электролиз әдісін пайдаланып қаптау
5) электролит ерітіндісі арқылы ток өткізу
30. Гальванопластика деп нені айтады?
1) металды полимерлеу әдісін пайдаланып коррозиядан қорғау
2) коррозияға берік құймалар алу
3) металл бұйымдарының бетін басқа металмен электролиз әдісін пайдаланып қаптау
4) пластмассадан жасалған бұйымдарды металмен қаптау
5) электролиз көмегімен заттың металдық көшірмесін жасау
Әдебиеттер тізімі
1. Аханбаев К.А. Химия. Алматы, 1993
2. Бірімжанов Б.А., Нұрахметов Н.Н. Жалпы химия.-Алматы. Ана
тілі, 1992. С. 683.
3. Бегалиева Д. У., Шоқыбаев Ж. Жалпы химия практикумы. Алматы,
Рауан, 1994
4. Бегалиева Ж. Самыратов С., Колушпаева Л. Химия курсы Алматы, 2001.
5. Шоқыбаев Ж. Бейорганикалық және аналитикалық химия. Алматы.2003
6. Ысқақова Р. А., Шоинбаева Ш.У., Қауменова Н. О. «Химия» курсы бойынша әдістемелік материалдар жиынтығы (оқытудың несиелік жүйесі), Алматы. 2004.
7. Глинка Н.Л. Общая химия.-М.: Высшая школа, 1999
8. Коровин Н.В. Общая химия-М.: Высшая школа,1999
9. Хомченко И.Г. Неорганическая химия.-М.: Высшая школа,1998.
10. Кульман А.Г. Общая химия.-м.: Химия,1979
11. Фролов В.В. Химия.-М.: Высшая школа,1999
12. Ахметов Н.С. Общая и неорганическая химия.-М.: Высшая школа,2000
13. Глинка Н.Л. Задачи и упражнения по общей химии.М.: Высшая школа,1984
14. Гольдбрайх З.Е. Сборник задач и упражнения по химии.-М.Л.:1984
15. Алябьев М.С., Горбачевская Л.А., Лернер М.И. Основы строения и реакционной способности авиационных материалов.-К.1987
16. Горбачевская Л.А., Применко В.И. Коррозия авиационной техники и методы защиты от нее.-К.:1977
17. Горбачевская Л.А., Лернер М.Е. Химические источники электрической энергии.-К.:1971
18. Бортникова Л.В. Общая химия.. Лабораторные работы.-А.:1998
19. Бортникова Л.В. Задачи и упражнения по общей химии. –А.:2002
20. ГОСТ8.417-81. Единицы физических величин.
21. Киреев В.А. Курс общей химии.-М.: Высшая школа,1972
22. Новиков Г.И. Основы общей химии.-М.: высшая школа,1988
23. Курс химии/под редакцией Лучинского Г.П. и др./.-М.: высшая школа,1972
24. Вульф Б.К., Романдин К.П. Авиационное материаловедение. -М.: Машиностроение,1967
25. Базелин С.А. От чего и как разрушаются металлы. -М.: Просвещение.1976.
ҚОСЫМША ДЕРЕКТЕР
1кесте
Қышқылдар, негіздер және тұздардың судағы ерігіштігі
| анион | OH- | Cl- | Br- | J- | S2- | SO32- | SO42- | NO3- | PO43- | CO32- | SiO32- | CH3COO- |
| катион | ||||||||||||
| H+ | Е | Е | Е | Е | Е | Е | Е | Е | Е | Е | ҚЕ | Е |
| NH4+ | Е | Е | Е | Е | - | Е | Е | Е | Е | Е | - | Е |
| Na+,K+ | Е | Е | Е | Е | Е | Е | Е | Е | Е | Е | Е | Е |
| Mg2+ | АЕ | Е | Е | Е | Е | ҚЕ | ҚЕ | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Ca2+ | АЕ | Е | Е | Е | АЕ | ҚЕ | АЕ | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Ba2+ | Е | Е | Е | Е | Е | ҚЕ | ҚЕ | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Al3+ | ҚЕ | Е | Е | Е | - | - | Е | Е | ҚЕ | - | ҚЕ | АЕ |
| Cr3+ | ҚЕ | Е | Е | Е | - | - | Е | Е | ҚЕ | - | ҚЕ | Е |
| Zn2+ | ҚЕ | Е | Е | Е | ҚЕ | ҚЕ | Е | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Mn2+ | ҚЕ | Е | Е | Е | ҚЕ | ҚЕ | Е | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Fe2+ | ҚЕ | Е | Е | Е | ҚЕ | ҚЕ | Е | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Fe3+ | ҚЕ | Е | Е | Е | - | - | Е | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Cu2+ | ҚЕ | Е | Е | Е | ҚЕ | ҚЕ | Е | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Ag+ | - | ҚЕ | ҚЕ | ҚЕ | ҚЕ | ҚЕ | АЕ | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Pb2+ | ҚЕ | АЕ | АЕ | ҚЕ | ҚЕ | ҚЕ | ҚЕ | Е | ҚЕ | ҚЕ | ҚЕ | Е |
| Hg2+ | - | Е | АЕ | ҚЕ | ҚЕ | ҚЕ | Е | Е | ҚЕ | ҚЕ | - | Е |
мұндағы Е - еритін зат
АЕ - аз еритін зат
ҚЕ - қиын еритін зат
2 кесте
Күшті және әлсіз электролиттер
| Күшті электролиттер - толық диссоциацияланатын қосылыстар. | Әлсіз электролиттер - аз диссоциациялана-тын қосылыстар. |
| Қышқылдар: HJ, HBr, HCl, HNO3, H2SO4, HClO4 | Қышқылдар: H2S, H2SO3, HNO2, H3PO4, H2CO3, H2SiO3, CH3COOH |
| Негіздер-сілтілер: LiOH, NaOH, KOH, RbOH, Ba(OH)2 , Sr(OH)2 | Негіздер: NH4OH және суда аз еритін негіздер (1 кестені қараңыз) |
| Тұздар: суда еритін барлық тұздар (1 кестені қараңыз) | Тұздар: суда аз еритін және қиын еритін тұздар (1 кестені қараңыз) |
Металдар белсенділігінің қатары
K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
3-кесте
298 К-дағы әлсіз электролиттердің диссоциация константалары
| Электролит | Сатылап жүретін диссоциация | ||
| К1 | К2 | К3 | |
| Қышқылдар: | |||
| Құмырсқа HCOOH | 1,8·10-4 | ||
| Сірке CH3COOH | 1,8·10-5 | ||
| Көмір H2СO3 | 4,0·10-7 | 5,6·10-11 | |
| Күкірт сутек H2S | 8,7·10-8 | 3,6·10-13 | |
| Фосфор H3PO4 | 4,9·10-3 | 5,6·10-7 | 4,5·10-12 |
| Аммоний гидроксиді | 1,8·10-5 |
4 кесте
Қышқылдар, сілтілер және тұздардың әртүрлі концентрациялы ерітінділерінің 150С-дағы тығыздығы (г/см3)
| Концен-трация,% | Тығыздық (г/см3) | |||||
| H2SO4 | HNO3 | HCl | NaOH | KOH | NaCl | |
| 1,027 | 1,022 | 1,019 | 1,046 | 1,033 | 1,029 | |
| 1,055 | 1,044 | 1,039 | 1,092 | 1,065 | 1,059 | |
| 1,083 | 1,068 | 1,059 | 1,137 | 1,100 | 1,089 | |
| 1,113 | 1,093 | 1,079 | 1,181 | 1,137 | 1,119 | |
| 1,143 | 1,119 | 1,100 | 1,225 | 1,176 | 1,151 | |
| 1,174 | 1,145 | 1,121 | 1,268 | 1,218 | 1,184 | |
| 1,206 | 1,171 | 1,142 | 1,310 | 1,263 | - | |
| 1,239 | 1,198 | 1,163 | 1,352 | 1,310 | - | |
| 1,273 | 1,225 | 1,183 | 1,395 | 1,358 | - | |
| 1,307 | 1,251 | - | 1,437 | 1,409 | - | |
| 1,342 | 1,277 | - | 1,478 | 1,480 | - | |
| 1,380 | 1,308 | - | 1,519 | 1,511 | - | |
| 1,419 | 1,328 | - | 1,560 | 1,564 | - | |
| 1,460 | 1,351 | - | 1,601 | 1,616 | - | |
| 1,503 | 1,373 | - | -1,643 | - | - | |
| 1,547 | 1,394 | - | - | - | - | |
| 1,593 | 1,412 | - | - | - | - | |
| 1,640 | 1,429 | - | - | - | - | |
| 1,687 | 1,445 | - | - | - | - | |
| 1,732 | 1,460 | - | - | - | - | |
| 1,776 | 1,474 | - | - | - | - | |
| 1,808 | 1,486 | - | - | - | - | |
| 1,830 | 1,496 | - | - | - | - | |
| 1,840 | 1,504 | - | - | - | - | |
| 1,838 | 1,552 | - | - | - | - |
5 кесте
Металдардың стандартты электродтық потенциалдары (сутек бойынша)
| электрод | электродтық реакцияның теңдеуі | Е0,В |
| Li/Li+ | Li=Li++ 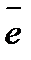
| -3,2 |
| K=K+ | K=K++ 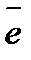
| -2,92 |
| Ca=Ca2+ | Ca=Ca2+ + 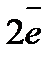
| -2,84 |
| Na=Na+ | Na=Na++ 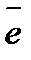
| -2,713 |
| Mg=Mg2+ | Mg=Mg2++ 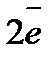
| -2,38 |
| Al=Al3+ | Al=Al3++3 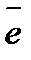
| -1,66 |
| Zn=Zn2+ | Zn=Zn2++ 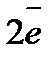
| -0,763 |
| Cr=Cr3+ | Cr=Cr3++3 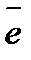
| -0,71 |
| Fe=Fe2+ | Fe=Fe2++ 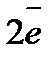
| -0,44 |
| Cd=Cd2+ | Cd=Cd2++ 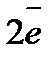
| -0,402 |
| Ni=Ni2+ | Ni=Ni2++ 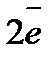
| -0,23 |
| Sn=Sn2+ | Sn=Sn2++ 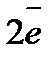
| -0,14 |
| Pb=Pb2+ | Pb=Pb2++ 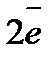
| -0,126 |
| Fe=Fe3+ | Fe=Fe3++3 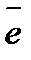
| -0,036 |
| H2=2H+ | H2=2H++ 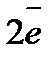
| 0,000 |
| Bi=Bi3+ | Bi=Bi3++3 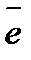
| +0,2 |
| Cu=Cu2+ | Cu=Cu2++ 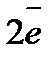
| +0,34 |
| Ag=Ag+ | Ag=Ag++ 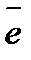
| +0,80 |
| Au=Au3+ | Au=Au3++3 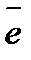
| +1,50 |
6 кесте
Жүйелік емес бірліктер және СИ жүйесі бірліктерінің арасындағы қатынас
| Шама | Бірлік | СИ жүйесіндегі эквиваленті |
| Ұзындық | Микрон және микрометр (мкм) | 1·10-6м |
Ангстрем  Å Å
| 1·10-10м | |
| Қысым | Физикалық атмосфера (атм) | 1,01325·105Па |
| миллиметр сынап бағанасы (мм с.б.) | 133,322Па | |
| Энергия, жұмыс және жылу мөлшері | Электронвольт (эВ) | 1,60219·10-19Дж |
| Калория (кал) | 4,1868Дж | |
| Килокалория (Ккал) | 4186,8 Дж | |
| Диполь моменті | Дебай | 3,33·10-30Кл•м |
7 кесте
СИ халықаралық жүйесінің кейбір бірліктері
Поиск по сайту: