 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Влажность. Теоретическая изотерма Ван-дер-Ваальса отличается от экспериментальной
Теоретическая изотерма Ван-дер-Ваальса отличается от экспериментальной. Иначе и быть не может, так как область между минимумом и максимумом описывает нестабильное состояние системы, которое не может быть реализовано. В этой области давление растет при увеличении объема и падает при уменьшении. Представим себе какое-нибудь состояние в этой области (точку на растущей ветви графика). Если в результате флуктуации внешняя сила, удерживающая газ в некотором объеме, несколько возрастет, то объем газа слегка уменьшится, и это, в отличие от обычных состояний, приведет к уменьшению давления газа. Испытывая меньшее сопротивление, внешняя сила сильнее сожмет газ, давление его еще уменьшится и т. д. Словом, такое состояние столь же нестабильно, как и равновесие иглы, стоящей на кончике.
Поэтому если газ изотермически сжимать (при Т<Тс), то при некотором значении объема V давление газа перестает меняться. На рисунке 1-1 это соответствует точке 1 на горизонтальном участке изотермы.
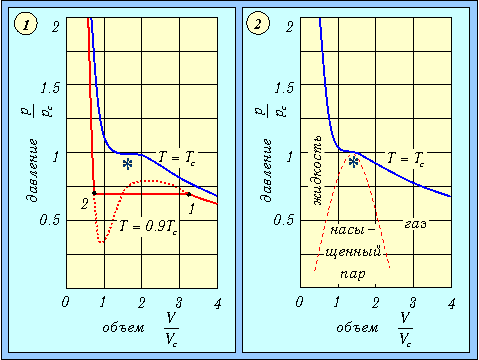
Рис. 1. Изотермы Ван-дер-Ваальса: штриховая часть изотермы при Т=0.9ТС соответствует неустойчивым состояниям газа (1); область насыщенного пара (2) получена соединением концов горизонтальных участков изотерм при различных температурах
На этом участке, происходит конденсация газа в жидкость: над жидкостью образуется насыщенный пар, давление которого рН(T) зависит только от температуры и потому не меняется. При дальнейшем уменьшении объема газа (сжатии) все большая его часть переходит в жидкое состояние. Наконец, при значении объема, соответствующем точке 2, весь газ переходит в жидкость, горизонтальный участок изотермы заканчивается и давление резко возрастает. Если построить такие горизонтальные участки изотерм для разных температур Т<Тс, то они заполнят область, граница которой показана штрихпунктирной линией на рисунке 1-2. Эта область (насыщенный пар) соответствует сосуществованию жидкой и газообразной фаз, справа от нее лежит область газообразной фазы, слева - жидкой.
При критической температуре Т=Тс горизонтальный участок изотермы стягивается в точку (показана звездочкой на рис. 2.9), называемую критической точкой.
Рассматривая рисунки, можно прийти к следующим выводам:
· При температуре выше критической вещество может существовать только в газообразном состоянии. Никаким сжатием газ при Т>Тс нельзя превратить в жидкость. В критической точке, определяемой параметрами состояния рс, Vc и Тс, исчезает различие между газом и жидкостью.
· Давление насыщенного пара рН(Т) не может превышать критического давления рс.
· Объем вещества в жидком состоянии не может превышать его критический объем.
Поиск по сайту: