 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Смеси газов
Возникает естественный вопрос: какими уравнениями описываются смеси идеальных газов? Ведь с чистыми газами нам редко приходится встречаться в природе. Например, наша естественная среда обитания - воздух - состоит из азота N2 (78.08%), кислорода O2 (20.95%), инертных газов (0.94%), углекислого газа СO2 (0.03%).
Пусть в некотором объеме V при некоторой температуре Т содержится смесь газов (которые мы будем нумеровать индексом i). Роль каждого компонента смеси будем характеризовать массовой долей:
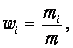
| (1.20) |
где mi - масса i -го компонента. Наша задача - написать уравнение, подобное уравнению Клапейрона - Менделеева, и разобраться с эффективным числом степеней свободы смеси, где могут содержаться и одноатомные, и многоатомные молекулы.
Прежде всего, заметим, что мы рассматриваем идеальные газы. Молекулы не взаимодействуют друг с другом, и потому каждый компонент не мешает любому другому «жить» в том же общем сосуде. Различные газы в сосуде просто не замечают друг друга. Поэтому для каждого из компонентов справедливо то же уравнение Клапейрона - Менделеева:

| (1.21) |
где ni - число молей вещества в i -м компоненте. Полное число n молей в смеси равно сумме числа молей ni в каждом из компонентов:

Аналогично, полная масса смеси равна сумме масс каждого из компонентов
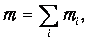
и естественно определить молярную массу смеси m как массу одного моля смеси:

Введем величину, называемую парциальным давлением.
| Парциальное давление pi - это давление, оказываемое i -м компонентом газовой смеси. |
Имеет место закон Дальтона для газовой смеси:
Полное давление газовой смеси равно сумме всех парциальных давлений
|
Суммируя левые и правые части (1.21), приходим к стандартной форме уравнения Клапейрона-Менделеева
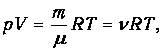
| (1.23) |
где т, m, n определяются из условия конкретной задачи. Например, если заданы массовые доли компонентов, то молярную массу смеси находим из соотношения

| (1.24) |
Внутренняя энергия Ui i -го компонента смеси определяется в соответствии с формулами (1.16) и (1.19):
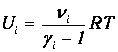
| (1.25) |
С одной стороны, полная внутренняя энергия смеси равна сумме энергий каждого компонента:

| (1.26) |
С другой стороны, запишем стандартное выражение вида (1.25)

| (1.27) |
Сравнивая (1.26) и (1.27), получаем формулу для показателя адиабаты смеси
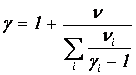
| (1.28) |
Найдя массу моля и показатель адиабаты смеси, мы можем пользоваться всеми формулами, полученными ранее для «чистых» идеальных газов.
Поиск по сайту:
