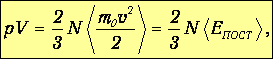|
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Кинетическая теория идеальных газов
В этом разделе мы переходим к молекулярно-кинетическому описанию идеального газа.
При выводе основного уравнения молекулярно-кинетической теории газов будем считать молекулы маленькими твердыми шариками, упруго отражающимися от стенок сосуда. Силы взаимодействия возникают только при соударении молекул друг с другом или со стенками сосуда. Припишем каждой молекуле номер i (i=1, 2,..., N), где N - полное число молекул в системе.
Пусть молекула i подлетает к стенке, ограничивающей движение вдоль оси х, со скоростью vix и импульсом pix. При отражении молекулы от стенки знак ее импульса меняется на противоположный - pix, так что изменение х -компоненты импульса молекулы равно

Молекула после отражения долетит до противоположной стенки, снова отразится и в следующий раз подлетит к той же стенке через время

где l - длина сосуда. Поскольку импульс Dpix передается стенке каждые Dt секунд, на стенку со стороны одной молекулы действует средняя сила

| (1.7) |
(Заметим на будущее, что средние значения величин мы будем обозначать угловыми скобками).
Если в сосуде заключено N молекул, то полная сила F получится суммированием выражения (1.8) по всем молекулам:

При этом сумма произведений импульсов на скорости представима в виде

Так как все направления равноправны и молекулы совершенно одинаково отражаются от всех стенок сосуда, имеем

С другой стороны, среднее значение произведения импульса молекулы на ее скорость определяется как

Поэтому

и выражение для полной силы, действующей на стенку со стороны газа, приобретает вид

| (1.8) |
Разделив полную силу на площадь стенки S, мы получим выражение для давления газа р, где заменим произведение Sl на объем V сосуда. В итоге приходим к уравнению

| (1.9) |
Используем теперь тот факт, что скорость движения молекул при обычных для нашего мира температурах много меньше скорости света, так что импульс молекулы представим в виде р=m0v, где т0 - масса молекулы. Получаем тогда из (1.9) соотношения, которые называют основным уравнением молекулярно-кинетической теории газов:
| (1.10) |
или
| (1.11) |
Здесь п - концентрация молекул, <ЕПОСТ> - средняя кинетическая энергия поступательного движения, приходящаяся на одну молекулу. Произведение N<ЕПОСТ> есть полная кинетическая энергия поступательного движения всех молекул газа в данном объеме V.
Быть может, на первый взгляд трудно узнать в соотношениях (1.10-1.11) сходство со знакомым нам уравнением Клапейрона-Менделеева

поэтому слегка преобразуем последнее. Введем новую величину - постоянную Больцмана

Важность этой физической постоянной определяется тем, что с ее помощью устанавливается связь между энергией и температурой, как это видно уже по ее размерности. Далее используем, что

- число молей вещества в системе, а NA - число молекул в одном моле, так что nNA равно полному числу частиц в системе. Приходим тогда к следующей форме уравнения Клапейрона-Менделеева:

| (1.12) |
Сравнивая (1.10) с (1.12), мы видим, что, в сущности, имеем дело с аналогичным уравнением, если определить абсолютную температуру соотношением
| (1.13) |
Именно так абсолютная температура появляется в физике. Слева в уравнении (1.13) стоит средняя кинетическая энергия поступательного движения молекул газа. При нулевой температуре, как мы теперь воочию убеждаемся, действительно прекращается тепловое движение молекул, и потому абсолютный нуль недостижим.
Поиск по сайту: