 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Ідентифікація. 1. За фізико-хімічними константами: температура плавлення, Іч- та УФ- спектроскопія, токошарова хроматографія
|
Читайте также: |
1. За фізико-хімічними константами: температура плавлення, Іч- та УФ- спектроскопія, токошарова хроматографія.
2. Реакція розщеплення в кислому або лужному середовищах з подальшою ідентифікацією утворених продуктів. Так, при нагріванні з розчином натрію гідроксиду виникає жовте забарвлення, що переходить у червоно-оранжеве, а при нагріванні утворюється цегляно-червоний осад і з’являється запах аміаку:

3. У фільтраті підтверджують наявність хлоридів після фільтрації реакційної суміші.
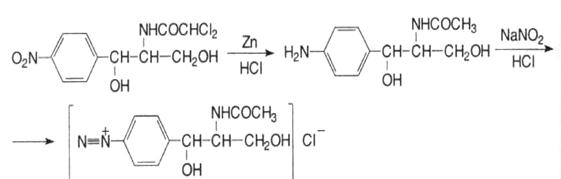
4. Реакція утворення азобарвника червоного кольору, після відновлення нітрогрупи до аміногрупи з подальшим діазотуванням та азосполученням:

5. Експрес-реакція з розчином міді сульфату у лужному середовищі в присутності н-бутанолу – спиртовий шар забарвлюється в синьо-фіолетовий колір внаслідок утворення комплексної солі:

Кількісне визначення:
1. Нітритометрія після попереднього відновлення нітрогрупи до аміногрупи цинковим пилом у кислому середовищі, s = 1:
2. Метод рідинної хроматографії.
3. Спектрофотометрія при γ = 278 нм.
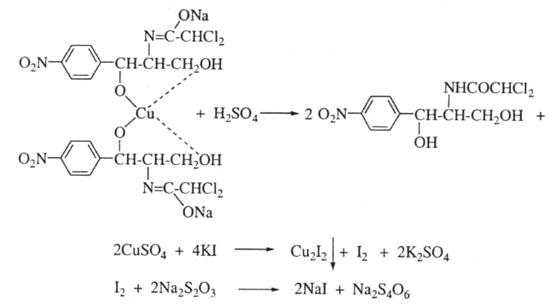
4. Куприметрія, пряме титрування. Метод грунтується на утворенні розчинної комплексної сполуки левоміцетину з міді сульфатом у лужному середовиші. Титрант - 0,01 М розчин міді сульфату, індикатор – мурексид. Титрують від фіолетового до коричнево- червоного забарвлення, папалельно проводять контрольний дослід, s = 2.
5. Куприйодметрія, пряме титрування за замісником. До розчину левоміцетину у лужному середовищі додають розчин міді сульфату. Осад гідроксиду міді відфільтровують, у фіотраті розчинний купри-левоміцетиновий комплекс руйнують дією кислоти сірчаної з утворенням еквівілентної кількості міді сульфату, яку визначають йодометрично, індикатор крахмаль,
s = 2:

6. Аргентометрія або меркуриметрія. Методи грунтуються на окисненні левлміцетину водню пероксидом у лужному середовищі, в результаті якого утворюються 2 молекули натрію хлориду, які визначають аргентометрично по Фольгарду, s = ½.
7. Фотоколориметрія по утвореному азобарвнику після відновлення нітрогрупи до аміногрупи з подальшим діазотування і азосполученням.
8. Йодометрія.
9. Броматометрія.
10. Ацидиметрія в еводному середовищі після кислотного гідролізу, s = 1.
Зберігання. У добре укупореній тарі, у склянках темного скла.
Застосування. Антибіотик широкого спекту дії, застосовується для лікування дизентерії, пневмонії, колюшу, черевного тифу та інших інфекційних захворювань.
Побічні ефекти. Порушує функцію кровотворних органів, може викликати дисбактеріоз.
Поиск по сайту: