 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Методи вивчення в фітоембріології: методики вивчення на фіксованому матеріалі та живих об’єктах
| ОТЧЕТ о выполнении практической работы по дисциплине ИНФОРМАТИКА | |||
| Студент …………. | Группа …………… | Дата ………………. | Операционная система ………………………………… |
| Номер пункта работы | Содержание | Результат выполнения пункта работы (копии экрана) | |
Методи вивчення в фітоембріології: методики вивчення на фіксованому матеріалі та живих об’єктах
На сьогодні у розпорядженні дослідника є великий арсенал методів
дослідження хімічного складу, структури і функцій клітин:
- світлової мікроскопії (з застосуванням темного поля фазового контрасту),
- ультрафіолетова, поляризаційна, флуоресцентна, інтерференційна
мікроскопія,
- методи цитохімії (якісні і кількісні),
- фракційне (диференційне) центрифугування, яке дає можливість вивчати
окремі клітинні компоненти (ядра, пластиди, мітохондрії, рибосоми, АГ,
хромосоми тощо),
- мічені атоми у поєднанні з радіоавтографією,
- спектрофотометричні,
- електронно-мікроскопічні,
- методи вивчення поодиноких клітин, тканин, органів поза організмом (у
разі їхнього культивування у штучних умовах) для вивчення газообміну,
хімічного складу, активності ферментів, сумісності, несумісності,
плоїдності, запліднення тощо.
- ферментної мацерації насінних зачатків.
Обираючи той чи інший метод дослідження дослідник має пам’ятати, що кожний метод має свої позитивні і негативні нюанси. Тому подолати обмеженість кожного методу можна досягти лише застосуванням їх комплексу. Тільки комплексне застосування різних прийомів дослідження тривалих і швидких, на живому матеріалі і фіксованому, дасть можливість всебічно вивчити ембріональні процеси і цитоембріональні ознаки у їхньому розвитку, динаміці, взаємодії з оточуючим середовищем.
Чим більш сучасними і різноманітними будуть прийоми досліджень, тим повніше, глибше і точніше ми проникнемо в сутність ембріологічних процесів для свідомого управління спадковістю.
Головним приладом цитологічних досліджень є світловий мікроскоп. Створено найрізноманітніші моделі світлових мікроскопів. Проте під світловим мікроскопом багато структур клітини залишаються непоміченими. Крім того, при цьму метолі дослідження живу клітину доводиться фіксувати (умертвляти), диференційовано її фарбувати. Та інколи фіксуючі препарати (спирт, кислоти, формалін, солі металів) і барвники можуть видозмінити істинну картину клітинної структури. У такому разі паралельно з вивченням постійних препаратів слід вивчати живі клітини. Останні зафарбовують:
цитоплазму – нейтральними барвниками, мітохондрії – янусомзеленим, комплекс Гольджі – метиленовим синім. Використовують і інші барвники, які легко проникають у живі клітини.
Для вивчення будови живої клітини створено мікроскопи фазово-контрастний, інтерференційний, поляризаційний, люмінісцентний.
Фазово-контрастний метод базується на тому, що різні ділянки прозорого препарату відрізняються один від одного за показником заломлення. В результаті відбувається зміщення яскравості і контрастності зображення. Цей метод відкриває широкі можливості при вивченні живих клітин, їхніх органел та різноманітних включень у нативному стані.
І нтерференційна мікроскопія також заснована на отриманні контрастного зображення незафарбованої живої клітини. Її проводять на спеціальних мікроскопах. При поляризаційній мікроскопії викистовують здатність деяких структур заломлювати поляризоване світло, що зв’язано з подвійним променезаломленням. За допомогою поляризаційного мікроскопа визначають орієнтацію часток в клітинах, виявляють структури з подвійним променезаломленням, спостерігають за надмолекулярною організацією різних зон клітини.
За допомогою люмінісцентного мікроскопа вивчають клітинні структури здатні до власної (первинної) люмінісценції. Люмінісценцією називають свічення об’єкта в результаті поглинання світлової енергії при дії ультрафіолотовими, синіми і фіолетовими променями. Так, хлорофіл хлоропластів має яскраво-червону люмінісценцію. Досить виразне свічення виявляють вітаміни А і В, а також деякі бактерії.
Проте більшість речовин клітини люменісцентні є лише після обробки їх спеціальними барвниками (вторинна люменісценція). До таких барвників належать акридин оранжовий, флуоресцин, барбаринсульфат, флоксин та інші. Так, акридин оранжовий зафарбовує ДНК в зелений, а РНК в оранжовий колір, що широко використовується при визначенні локалізації нуклеїнових кислот в клітинах. Люменісцентний метод дає можливість виготовити контрастні препарати, а також визначати функціональний стан окремих клітин. Цей метод часто застосовував у своїх дослідженнях О. В. Брайон.
Вивчення клітинних структур на молекулярному рівні за допомогою електронного мікроскопа проводять на попередньо фіксованих і виготовлених препаратах. Їх розглядають на світловому екрані або фотографують.
У наш час широкого розповсюдження набули дослідження не лише морфологічних структур, а й хімічного складу і хімічної динаміки клітин.
Успішному вивченню окремих клітинних органел – ядра, хромосом, пластид, рибосом,мітохондрій сприяло застосування фракційного центрифугування.
Хімічний склад клітини можно визначии і на основі вибіркового поглинання молекулами інфрачервоних, ультрафіолетових, рентгенівських променів.
- метод цитофотометрії – дає можливість встановити не лише якісний, а й кількісний склад внутріклітинних структур.
Використання мікроманіпуляторами (ядро з клітини радіоактивних ізотопів, мікрохірургію трансплантують в інші) культури клітин і тканин, ізольованих протопластів,…
3. ЗНАЧЕННЯ ЕМБРІОЛОГІЧНИХ ДОСЛІДЖЕНЬ ДЛЯ СИСТЕМАТИКИ, ФІЛОГЕНІЇ, ГЕНЕТИКИ, СЕЛЕКЦІЇ, БІОТЕХНОЛОГІЇ.
Численними ембріологічними дослідженнями останніх років встановлено велике різноманіття типів будови і розвитку цитоембріологічних ознак, що дає можливість використовувати їх в систематиці і філогенії різних таксономічних груп.
Поступово розвиваючись цитоембріологічний метод дослідження зайняв почесне місце поряд з морфологічними, каріологічними, палеонтологічними, анатомічними, біохімічними, фізіологічними і іншими методами. Разом з тим накопичуються дані по розвитку пилку, зародкового мішка, життєздатності пилку і маточки, заплідненню, розвитку зародка і ендосперму для уточнення і поглиблення знань біології цвітіння і розмноження культурних рослин, від пізнання яких залежить вибір того чи іншого метода генетико–селекційних робіт.
Ембріологічний метод допомагає зрозуміти сутність складних і різноманітних генетичних змін, які мають місце під час розмноження рослин, виявити їхню залежність від умов зовнішнього середовища на найбільш ранніх стадіях розвитку.
В селекції завдячуючи ембріологічним дослідженням раціоналізують постановку робіт по схрещуванню, пояснюють появу організмів з односторонньою (лише батьківськими чи лише материнськими) спадковістю, причини і характер несхрещуваності, стерильності, невдачі інцухту, поліембріонії, партенокарпії, апоміксису тощо.
Таким чином, детальне вивчення процесу розмноження і перебігу ембріонального розвитку культурних рослин стає необхідною умовою для правильного вибору метода генетико–селекційних робіт.
Намагаючись проникнути в сутність фундаментальної проблеми біології розвитку - пізнання механізмів диференціальної експресії генів в процесі онтогенезу - дослідники застосовують спрощені модельні системи, в той час як найбільш адекватним, повноцінним і природним модельним об’єктом може бути зародок рослин. Тобто, чим більш повними і детальними будуть наші знання ембріогенезу, його критичних етапах, регуляторних факторах, тим ближче ми підійдемо до рішення фундаментальних проблем росту й розвитку рослин, створенню теорії онтогенезу.
З вищевикладеного видно, що ембріологічні дослідження мають з одного боку, теоретичне, а з другого - практичне значення. Теоретичне значення їх обумовлено можливістю встановлення систематичних і філогенетичних стосунків між групами рослин, а, отже, еволюцію рослинного світу від нижчих форм до вищих, з врахуванням не лише зовнішніх, а й внутрішніх ознак.
Дослідження ембріогенезу мають ще й практичний аспект: підвищення насінної продуктивності, життєздатності і схожості насіння, поліпшення його якості, можливості раціональніше і успішніше проводити генетико-селекційні роботи, які мають привести до оволодіння формотворчим процесом і знаходженню способу свідомого управління ним з метою отримання практично цінних форм культурних рослин.
Вивчення розвитку, будови і проростання пилку на штучному середовищі і на приймочках дає можливість встановити якість пилку, і тим самим якість того чи іншого сорту як запилювача. Наскільки важливо знати якості рослин-запилювачів, чітко продемонстрував Г.Турсин (1972,1973) на прикладі промислових плантацій сальвії лікарської (Salvia officinalis). Дослідник проаналізував популяції цих плантацій і прийшов висновку, що причиною низької насінної продуктивності є велика кількість рослин з чоловічою стерильністю і що збільшення числа рослин з фертильним пилком значно збільшить урожай. Виходячи з цього він запропонував нову методику насінництва сальвії лікарської, в результаті чого врожай її насіння зріс у 10-15 раз.
Не менш важливе значення має оцінка якості сортів чи форм рослин –запилювачів при визначенні і розподілі їх на плантації плодових і ягідних культур.
Відомо також, що фітопродуктивність в значній мірі залежить від біологічних особливостей материнської рослини як продуцента плодів і насіння. Тому вивчення характеру розвитку, будови насінного зачатка і зародкового мішка дає можливість дійти висновку про якість материнської рослини, а вивчення розвитку пилку і зародкового мішка – розмножується дана рослина статевим шляхом чи апоміктично.
Знання життєздатності пилку, насінних зачатків, приймочок і яйцеклітини вкрай важливо для визначення строків штучного запилення і обсягів робіт по схрещуванню, встановлення оптимальних норм просторової чи почасової” ізоляції ділянок гібридизації, розмноження батьківських форм та насіння F1.
Для вибору методики генетико-селекційних робіт надзвичайно важливо встановити характер запилення, адже є рослини само- і перехресно стерильні, інші – само- і перехресно фертильні, а, отже, вони по різному реагують на самозапилення, що необхідно враховувати при підборі запилювачів. Цитоембріологічні дослідження проростання пилку на приймочках, росту пилкових трубок в тканиних маточки, перебігу процесів запліднення, розвитку зародка, ендосперму, насіння і плоду при само- і перехресному запиленнях дозволяють швидше і точніше вирішити питання про належність тієї чи іншої рослини до груп самостерильних і самофертильних. На прикладі плодових і ягідних культур видно, що підбір фізіологічно сумісних сортів на плантаціях є однієюз умов отримання високих урожаїв.
Оскільки усі ембріологічні процеси залежать від зовнішніх умов, то це потребує вивчення і встановлення тих стадій ембріогенезу на яких цілеспрямована дія того чи іншого фізичного чи хімічного чинника виявиться найбільш ефективною при отриманні нових сортів культурних рослин.
Знання специфіки обміну речовин при різних ембріональних процесах у взаємозв’язку з умовами зовнішнього середовища дає можливість управління розвитком рослин і оволодіння новими ефективними методами створення практично цінних сортів і гібридів.
Ембріологічні дослідження набувають особливої значимості у наш час коли так гостро постала проблема збереження біорізноманіття на Землі. Так, на ХYI Міжнародному ботанічному конгресі в США ще 1999р. було наголошено, що у разі не прийняття рішучих дій у найближчі терміни по збереженню видового різноманіття рослин, то до середини ХХ1 ст. 2/3 із
300 тис. видів рослин, що зростають на Землі, можуть бути втраченими. Одним із максимально ефективних напрямків по збереженню рідкісних, вимираючих природних і селекції нових господарсько цінних видів є їх штучне розмноження і вирощування, у тому числі і у культурі in vitro.
Перевага цього методу полягає в тому, що він дає можливість у короткі терміни отримати багато посадкового матеріалу (великий коефіцієнт розмноження), і вирощувати тисячі рослин незалежно від пори року.
Крім того, культивування зародків (ембріокультура), що вже бурхливо розвивається, дає можливість зберегти унікальні генотипи, отримані від міжвидового і міжродового схрещування, які гинуть при застосуванні традиційних методів селекції, пришвидшити процес штучного отримання і розмноження поліплоїдних форм.
У сільському господарстві та практиці декоративного садівництва цей метод особливої ваги набуває і з комерційного інтересу. На даний час кількість рослин, що культивуються «у пробірці» уже сягає майже 1 тис. назв. Більше ніж у 100 видів даний метод реально комерційно застосовується, серед них декоративні, плодово-ягідні, лікарські, деревні та інші культури (Лутова, 2003).
Примітка ДИВ.с 47 табл1 Поддубная – Арнольди, 1976
Ембріологія рослин, наука про зародження і формування нового рослинного організму. У ширшому сенсі Е. р. вивчає не лише розвиток зародка, але і період формування генеративної сфери утворення в ній статевих клітин, запилення і запліднення. Е. р. — один з найважливіших розділів ботаніки зі своїми методами і завданнями.
В Е. р. можна виділити:
загальну Е. р., що виявляє основні закономірності виникнення і розвитку генеративних і ембріональних структур (спорогенез, гаметогенез, зиготогенез, ендоспермогенез, ембріогенез, апоміксис і ін.);
порівняльну Е. р., що вивчає ембріологічні процеси у різних видів рослин для вирішення проблем систематики і філогенії;
спеціальну Е. р., присвячену вивченню цих процесів у рослин окремих систематичних груп (культурних і корисних людині дикорослих рослин, що необхідно для генетико-селекційних робіт;
експериментальну Е. р., що відтворює в умовах експерименту хід розвитку рослинних організмів, з тим щоб з'ясувати функціональну, біохімічну і генетичну природу ембріональних процесів.
Короткий нарис розвитку Е. р.
Наявність зародка у рослин була відома з прадавніх часів. Проте античні теорії зародження рослинних організмів були далекі від дійсного розуміння ембріональних процесів. Лише у 2-ій половині 17 ст з винаходом мікроскопа вперше удалося розглянути яйцеклітину і зародок в насінному зачатку квіткових рослин.
Для становлення Е. р. велике значення мали роботи І. Кельрейтера по біології цвітіння, запліднення і гібридизації рослин, що проводилися в Петербурзькій АН(Академія наук) в 1756—61, а також дослідження Д. Вольфа («Теорія зародження», 1759 і 1764).
Як самостійна наука Е. р. склалась в 19 ст, коли значно зріс інтерес до природознавства у зв'язку із створенням клітинної теорії і еволюційного учення Ч. Дарвіна. Розвитку Е. р. сприяло вдосконалення оптики і техніки виготовлення мікроскопічних препаратів.
Дослідження статевого розмноження у вищих рослин, особливо квіткових, привело до більш поглибленого вивчення чоловічих і жіночих статевих елементів. У 1-ій половині 19 ст було відкрито проростання пилку і утворення пилкової трубки на приймочці (італійський ботанік Дж. Амічі, 1823; французький А. Броньяр, 1827; німецький Ф. Мейн, 1841).
Проте абсолютно неправильно вважали, що зародок розвивається з кінчика пилкової трубки, коли вона проникає в зародковий мішок. Цієї точки зору дотримувався і один з авторів клітинної теорії німецький ботанік М. Шлейден (1836, 1838), який пізніше (1856) визнав помилковість своїх поглядів, але вважав, що пилок є жіночим органом, а зародковий мішок — чоловічим.
Російський ботанік Н. І. Железнов (1840, 1842) прийшов до правильного висновку про приналежність пилку чоловічому організму. В середині 19 ст з'явилися фундаментальні дослідження німецького ботаніка В. Гофмейстера (W. Hofmtister, 1851), в яких він отримав дані по онтогенезу квіткових і спорових рослин і затвердив в науці уявлення про чергування статевого і безстатевого поколінь.
Російський ботанік І. М. Горожанкін (1880) встановив, що кінець пилкової трубки в голонасінних при заплідненні вростає в порожнину яйцеклітини, де і відбувається «змішування» чоловічої і жіночої цитоплазми, а чоловіче статеве ядро після виходу з пилкової трубки об'єднується з ядром яйцеклітини. Таким чином, вперше була встановлена дійсна картина запліднення в голонасінних.
Учень І.Горожанкіна В. І. Беляєв продовжив дослідження в цьому напрямі (1889, 1891), а також вивчив редукцію чоловічого гаметофіту (1894, 1901), розвиток антеридію і процес запліднення в різноспорових папоротеподібних. Ці роботи зіграли велику роль у встановленні зв'язків філогенезу серед архегоніальних рослин. В. І. Беляєв виявив також, що сперматозоїди папоротеподібних містять цитоплазму. Ці дані заперечили домінуюче у той час у західноєвропейській літературі уявлення про те, що сперматозоїди складаються лише із ядра.
Рухливі спермії в саговників і гінкго відкрили японські ботаніки С. Хиразе (1896) і С. Ікено (1898) і американський дослідник Г. Д. Чеббер (1897). Велике значення для виявлення філогенезу архегоніальних рослин мали роботи російських ботаніків Е. М. Соколової (1890) і В. І. Арнольді (1900, 1907). ботанік Б. Ханштейн (1870) розробив концепцію ініціальних шарів (дерматоген, периблема, плерома), з яких формуються постійні тканини дорослого організму. Російський ботанік С. М. Розанов (1865, 1866) започаткував порівняльну ембріологію водолистних, бурачникових і ін.
Ділення ядра клітини вперше виявив росіянин І.Д.Чистяков(1874) під час вивчення розвитку спор плауна і хвоща. 1878 р. за пропозицією В.Шлейхера ділення ядра отримало назву каріокінез (грецьк.karyon – ядро і kinesis - ділення).
У 1875 р. Е.Страсбургером також було детально описано ділення заплідненої яйцеклітини ялини. Він же запропонував терміни: „профаза”,” метафаза”, „анафаза”, ” гаплоїдне” і „диплоїдне” число хромосом.
А. С. Фамінцин детально досліджував ембріогенез як у дводольних, так і в однодольних рослин. В кінці 19 ст С. Г. Навашин (1898) відкрив раніше невідоме явище подвійного запліднення в покритонасінних, коли два спермії, привнесених пилковою трубкою в зародковий мішок, запліднюють: один — ядро яйцеклітини, а другий — вторинне ядро центральної клітини. В результаті в першому випадку виникає диплоїдний зародок, в другому — триплоїдний ендосперм. Аналогічний характер процесу запліднення пізніше підтвердили французький ембріолог
Л. Гиньяр (1899), а також німецький ботанік Е. Страсбургер (1900).
Для здійснення цього знаменного відкриття потрібно було: відсутність найменшої передумовності, вишукана спостережливість і передбачливість, віртуозна техніка мікроскопії. Усі ці якості були притаманні С.Г. Навашину. Ним була створена у Києві школа ембріологів і цитологів, його учнями були М.В.Цингер, Я.М. Делоне, Г.О.Левитський, В.В.Фінн, Я.С.Модилевський, М.С.Навшин, В.М.Хитров, М.В.Чернояров та багато інших.
Подальшому поглибленому вивченню ембріональних процесів присвячені огляди по морфології і ембріології голонасінних (американські учені Дж. Колтер і Ч. Чемберлен, 1910, 1915, німецький морфолог До. Шнарф, 1933) і покритонасінних (Шнарф, 1927—29, 1931). В цей же час (1934—39) Р. Суеж (Франція) і його учні розробили принципи класифікації ембріональних типів у покритонасінних, виявили основні закономірності ділення клітини, процесів сегментаціі та диференціації зародка.
В 50-і рр. під керівництвом індійського ботаніка П. Магешварі виникла школа дослідників (Р. Капіл, Би. Свамі, Ст. Тіаги, Н. Бхандарі і ін.), що вивчали порівняльну ембріологію багатьох тропічних родин квіткових рослин. Згодом увага ембріологів (особливо індійських — Н. Рангасвамі, 1961; П. Магешварі і К. Канта, 1962, Б. Джорі і К. Сенгал, 1963, і ін., Б. Джорі, 1971, 1975) була спрямована на розробку методів по штучному вирощуванню зав'язей, насінних зачатків, пилку, ендосперму і зародків, по вивченню запліднення і апоміксису. У розробці проблем гаметогенезу і апоміксису велика роль належить шведським ембріологам Х. Юелю (1915), О. Дальгрену (1940), Ф. Фагерлінду (1944) і О. Густафсону (1946). Успіхи порівняльної ембріології голонасінних і покритонасінних відображені в багатьох зведеннях (американського ботаніка Д. Джохансена, радянського ботаніка Я. С. Модилевського і ін.).
Англійський морфолог К. Уордлоу вперше (1955) підсумував знання по розвитку зародка у всіх класах рослинного світу — від водоростей до квіткових рослин. Ембріогенез розглядається на тлі індивідуального і історичного розвитку з врахуванням морфологічних і функціональних особливостей груп, що вивчаються. Велике значення для подальшого розвитку Е. р. мала монографія радянського ученого П. А. Баранова (1955), у якій в історичному аспекті розглядаються уявлення про зародження і розвиток організмів від античного часу до наших днів.
Послідовний виклад сучасних поглядів на розвиток генеративних і ембріональних структур даний в роботах В. А. Піддубна-Арнольді (1964, 1976),
Г. Л. Девіс (1966), а також в навчальному посібнику польського ембріолога Б. Родкевича (1973) і італійського — Е. Баттальі (1976). У теоретичному плані великі роботи ведуться у Франції з проблеми статевого процесу і ембріогенезу в голо- і покритонасінних рослин (Б. і Ж. Вазар, 1958—1969; А. Камер, 1958—69; Л. Гиньяр 1961—69; Же. Ш. Местр, 1967; М. Фавр-Дюшартр, 1963—69), у США — по ультраструктурі гаметофітів, зародка, ендосперму і процесу запліднення в квіткових рослин (В. Енсен, 1965—1975).
Радянські ембріологи розробили мітотичну гіпотезу подвійного запліднення у покритонасінних (Е. Н. Герасимова-Навашина, 1951—55), відкрили і детально досліджували новий тип ембріогенезу в півоній (М. С. Яковлєв, 1951; М. С. Яковлєв і М. Д. Іоффе, 1957—61), висунули нову концепцію еволюції гаметогенезу в покритонасінних рослин (М. С. Яковлєв, 1974); розробили класифікацію типів зародкових мішків (І. Д. Романів, 1971), розкрили цитоембріологічні закономірності проростання пилкових трубок і запліднення, у тому числі і у віддалених гібридів і поліплоїдів (Е. Н. Герасимова-Навашина, 1955—71; С. А. Поддубная-Арнольди, 1964—76; Р. С. Канделаки, 1969; Т. Б. Батыгина, 1974; С. П. Банникова, 1975, і ін.). Проводиться поглиблене вивчення явища апоміксису і поліембріонії (С. С. Хохлов, 1946—73; Д. Ф. Петров, 1963—73; М. П. Солнцева, 1968—73, і ін.).
Широко ведуться дослідження по екологічній ембріології, що дає можливість пов'язати еволюцію ембріональних структур з чинниками зовнішнього середовища (біотичними стосунками, поведінковими реакціями і т. п., Е. С. Терехин, 1968—77). У СРСР і за кордоном активно розвивалась експериментальна Е. р. з вживанням цито- і гістохімічних методів дослідження культур кліток, тканин і генеративних органів; розробляються нові методи прижиттєвих спостережень при використанні фазовоконтрастної, аноптральної і ультрафіолетової мікроскопії, мікрокінозйомки. Особливого значення набувають дані електронної і скануючої мікроскопії, завдяки яким невимірно розсувалися кордони знань про ембріональні структури.
Сучасні проблеми Е. р. Характерною межею сучасної Е. р. є щонайтісніше переплетення теорії і практики. Зусилля ембріологів направлені на пошуки закономірностей таких складних явищ, як мікро- і макрогаметогенез, процес подвійного запліднення, ембріо- і ендоспермогенез, поліембріонія і апоміксис.
Вивчення цих процесів має величезне значення для розробки проблеми еволюції і філогенії, формо- і видоутворення. Рішення багатьох завдань, що стоять перед генетиками і селекціонерами, також базується на дослідженнях Е. р. (віддалена гібридизація, стерильність, апоміксис і ін.). Генезис чоловічих і жіночих гамет, їх виникнення і еволюція в різних філах рослинного світу стоять у числі основних проблем Е. р. На черзі —і питання перегляду уявлень про гомологію зародкового мішка і пилкового зерна покритонасінних з гаметофітом архегоніальних рослин. Подальшої розробки потребують і чимало питань апоміксису, поліембріонії, партенокарпії.
Наукові центри і періодичні видання по Е. р.
В Україні - інституті ботаніки УНАН, Одеському селекційно-генетичному інституті. В Росії проблеми Е. р. розробляються в Ботанічному інституті ім. акад. В. Л. Комарова РАН, Головному ботанічному саду РАН; інституті рослинництва (Санкт-Петербург), на кафедрах Московського, Казанського, Уфімського університетів, інституті ботаніки АН Грузії, в Ботанічному саду АН Молдови, інституті експериментальної біології рослин і інституті ботаніки АН Узбекистану, Єреванського університетів і у низці інших навчальних і науково-дослідних установ. Міжнародні наукові центри зосереджені головним чином у відділеннях ботаніки університетів багатьох країн (Франція, Індія, США, Сербія, Польща, Австрія, Японія, Чехія і ін.).
Розділ 1а
Структурні, функціональні та генетичні особливості рослинної клітини
1.Структурні складові рослинної клітини
1.1 структура, хімічний склад, фунція ядра
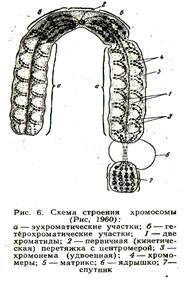
1.2 Хромосоми
1.3 Ділення клітини (мітоз, мейоз, ендомітоз, амітоз)
1.4 Інші хромосомні набори



Організація хроматину у клітинах рослин і тварин. Зверніть увагу: на групи білкових молекул (вони мають вигляд кульок) накручені нитки молекули нуклеїнової кислоти. Хроматин може мати неущільнені (1) та ущільнені (2) ділянки. У разі ущільнення хроматину формуються хромосоми.
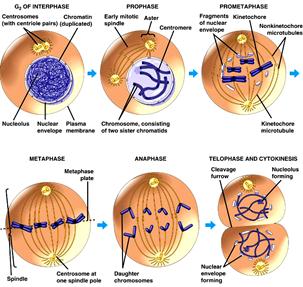
МІТОЗ - спосіб розмноження соматичних клітин любого організму. Суть мітозу: з однієї початкової клітини утворюється дві, абсолютно однакові за генетичною інформацією як між собою, так і з материнською клітиною.
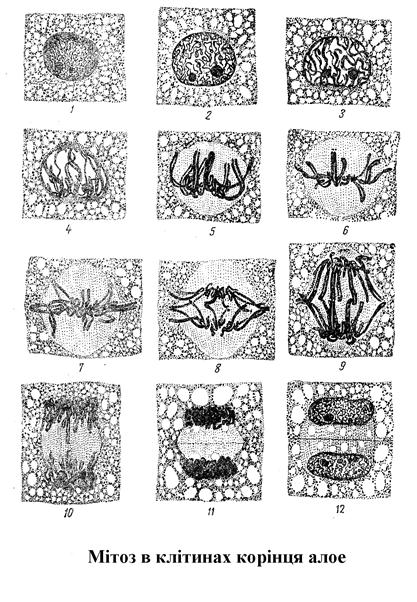
1-інтерфазне ядро, 2-4-профаза, 5-7- метафаза, 8-10-анафаза, 11-телофаза, 12- цитокінез.
Як це відбувається?. В нормі у передсинтетичний період інтерфази G1 усі соматичні клітини багатоклітинних організмів мають двійний (диплоїдний) набір хроматинових ниток ДНК – 2n (де n - гаплоїдний, одинарний набір ниток ДНК, який надбала клітина підчас утворення зиготи від кожного із батьків), тобто кожна нитка хроматину має собі парну – гомологічну. (Тут навмисно не використовується термін „хромосома”, бо у цей період як таких хромосом ще немає. Чому говорять „гомологічну”, а не „ ідентичну”? Тому, що у гомологів лише сам перелік ознак однаковий, а кожна з ознак може перебувати в цих двох гомологах, або в однаковому стані (АА, аа), або в альтернативному (Аа). При тому, важливо пам’ятати, що кожна нитка при цьому – однохроматидна – 1с, тобто в 2n хроматиновому наборі гомологів – 2с хроматинової інформації.
Після реплікації нитки ДНК сильно спіралізуються, перетворюються у хромосоми,
Кожна з них складається з двох хроматид (2 n4с).
І лише після завершення постсинтетичного періоду інтерфази G2, підготувавши усе необхідне, клітина розпочинає поділ ядра каріокінез або мітоз, а потім відбувається і саме ділення клітини – цитокінез.
N2с
Інтерфаза (2n2с)→ реплікація ДНК→2n4с → мітоз‹
N2с
Поиск по сайту: