 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Излучение и поглощение света атомом водорода
Расчеты показывают, что вероятность P нахождения электрона с энергией En внутри атома водорода не зависит от времени и не изменяется с течением времени. Следовательно, энергетическое состояние электрона, характеризуемое определенной энергией En, является стационарным. Находясь в этом состоянии, электрон не излучает энергии.
Стационарное состояние атома должно сохраняться как угодно долго, если нет внешних причин, вызывающих изменение энергии атома. Однако, как показывает опыт и доказывает квантовая физика, атом, находящийся в возбужденном энергетическом состоянии En, сам собой переходит в более низкое энергетическое состояние Em (спонтанное излучение). Каждый переход из состояния n в состояние m сопровождается излучением спектральной линии с частотой ν, причем
 (85.1)
(85.1)
где h ν — энергия испускаемого фотона.
При взаимодействии с электромагнитным полем атом, находящийся на уровне m, может поглотить фотон с энергией
 (85.2)
(85.2)
и перейти в более высокое энергетическое состояние n — происходит поглощение света.

|
|
Расчеты показывают, что для атома водорода энергетические переходы возможны только при изменении орбитального квантового числа на единицу:  (см. рис. 85.1, на котором в виде горизонтальных линий представлены энергетические уровни, в виде вертикальных стрелок — возможные энергетические переходы в атоме водорода).
(см. рис. 85.1, на котором в виде горизонтальных линий представлены энергетические уровни, в виде вертикальных стрелок — возможные энергетические переходы в атоме водорода).
Можно определить частоту спектральных линий атома водорода по формуле
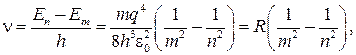 (85.3)
(85.3)
где m и n — целые числа; R — постоянная Ридберга.

Тщательные исследования спектра атома водорода показали, что в нем наблюдается шесть серий спектральных линий:
— в ультрафиолетовой области
серия Лаймана: m = 1, n =2, 3, 4, …;
— в видимой области
серия Бальмера: m = 2, n =3, 4, 5, …;
— в инфракрасной области
серия Пашена: m = 3, n =4, 5, 6, …;
серия Брэкета: m = 4, n =5, 6, 7, …;
серия Пфунда: m = 5, n =6, 7, 8, …;
серия Хэмфри: m = 6, n =7, 9, 9, ….
Пример 85.1. Определить длину волны линии спектра испускания атома водорода, излучаемой при переходе электрона с четвертого энергетического уровня на второй.
| Дано: n = 4 m = 2 | Решение
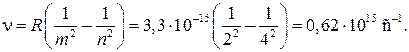
|
| λ –? |

Ответ: 
Поиск по сайту: