 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Уравнение Ван-дер-Ваальса
Уравнение состояния идеального газа (уравнение Клапейрона – Менделеева)
 |
(29.1)
было получено в предположении, что молекулы газа имеют пренебрежимо малый собственный объем, не взаимодействуют друг с другом на расстоянии и сталкиваются между собой как упругие шарики. Очевидно, такое допущение можно делать только для газов при небольших давлениях (~1 атм), когда расстояния между молекулами газа таковы, что силами межмолекулярного взаимодействия можно пренебречь (при 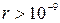 м).
м).
Модель газа, отличная от модели идеального газа, была предложена Ван-дер-Ваальсом. Согласно этой модели, молекулы газа имеют собственный объем, взаимно притягиваются друг к другу и сталкиваются между собой как упругие шарики. Такая модель позволила получить уравнение состояния газа, более соответствующее свойствам реальных газов, чем уравнение Клапейрона – Менделеева. Это уравнение, называемое уравнением Ван-дер-Ваальса, имеет вид
 |
(29.2)
где  и
и  — постоянные для данного газа величины, которые определяют опытным путем.
— постоянные для данного газа величины, которые определяют опытным путем.
Уравнение (29.2) отличается от уравнения (29.1) двумя поправками:  и ν b. Поправка
и ν b. Поправка  учитывает действие молекулярных сил притяжения, которое эквивалентно действию дополнительного давления, испытываемого газом. Величина этого дополнительного давления
учитывает действие молекулярных сил притяжения, которое эквивалентно действию дополнительного давления, испытываемого газом. Величина этого дополнительного давления
 |
(29.3)
Поправка ν b учитывает собственный объем молекул. Она равна учетверенному собственному объему всех молекул газа.
Поиск по сайту: