 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Энтропия
Набором макроскопичесих параметров, например,  и
и  , задается состояние системы в целом или макросостояние системы. Набор параметров
, задается состояние системы в целом или макросостояние системы. Набор параметров  и
и  выражает осредненное суммарное состояние большого числа молекул, из которых состоит система. Назовем микросостоянием системы состояние всех молекул, образующих систему. Состояние каждой молекулы определяется заданием ее координат и скорости в данный момент времени. Очевидно, что микросостояние системы непрерывно меняется. Однако набор макроскопических параметров
выражает осредненное суммарное состояние большого числа молекул, из которых состоит система. Назовем микросостоянием системы состояние всех молекул, образующих систему. Состояние каждой молекулы определяется заданием ее координат и скорости в данный момент времени. Очевидно, что микросостояние системы непрерывно меняется. Однако набор макроскопических параметров  и
и  , а следовательно, и макросостояние системы при этом может не меняться. Назовем термодинамической вероятностью
, а следовательно, и макросостояние системы при этом может не меняться. Назовем термодинамической вероятностью 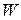 число различных микросостояний, соответствующих данному макросостоянию.
число различных микросостояний, соответствующих данному макросостоянию.
Вероятность макросостояния пропорциональна его термодинамической вероятности. Для равновесного состояния системы, при котором параметры 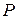 ,
,  , и
, и  остаются неизменными,
остаются неизменными, 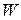 имеет максимальное значение по сравнению с любым неравновесным состоянием. Поэтому равновесное состояние наиболее вероятно. Если система переходит из неравновесного состояния в равновесное, то такой процесс необратим.
имеет максимальное значение по сравнению с любым неравновесным состоянием. Поэтому равновесное состояние наиболее вероятно. Если система переходит из неравновесного состояния в равновесное, то такой процесс необратим.
Определить вероятность состояния через термодинамическую вероятность неудобно, так как 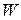 не обладает свойством аддитивности (нельзя складывать). Действительно, если мысленно разбить термодинамическую систему на
не обладает свойством аддитивности (нельзя складывать). Действительно, если мысленно разбить термодинамическую систему на 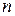 подсистем с термодинамическими вероятностями
подсистем с термодинамическими вероятностями  (рис 25.1),
(рис 25.1),
|
Рис. 25.1
то термодинамическая вероятность системы
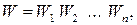 (25.1)
(25.1)
откуда видно, что 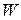 не является аддитивной величиной.
не является аддитивной величиной.
Взяв логарифм от соотношения (25.1), получим
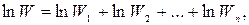
откуда видно, что 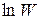 — аддитивная величина (можно складывать).
— аддитивная величина (можно складывать).
Введем физическую величину
 (25.2)
(25.2)
где 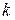 — постоянная Больцмана. Величину
— постоянная Больцмана. Величину  называют энтропией системы. Она характеризует вероятность макросостояния системы. Определение энтропии (25.2) было сделано Больцманом.
называют энтропией системы. Она характеризует вероятность макросостояния системы. Определение энтропии (25.2) было сделано Больцманом.
Дадим еще одно определение энтропии. Рассмотрим расширение газа в пустоту (рис. 25.2).

|
Рис. 25.2
Расчет дает
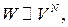
где 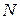 — число молекул газа в объеме
— число молекул газа в объеме  , или
, или
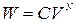 ,
,
где 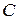 — коэффициент пропорциональности.
— коэффициент пропорциональности.
Очевидно, в нашем случае 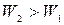 , так как
, так как  . С учетом выражения (25.2) можем написать
. С учетом выражения (25.2) можем написать

откуда приращение энтропии

(25.3)
Учитывая, что  и
и 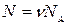 , перепишем выражение (25.3) в виде
, перепишем выражение (25.3) в виде
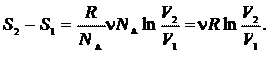 |
(25.4)
При изотермическом увеличении объема газа от 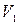 до
до 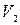 при температуре
при температуре  количество тепла, полученное газом,
количество тепла, полученное газом,
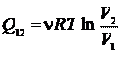 |
(25.5)
(см. пример 23.1). Сравнивая выражение (25.4) и (25.5), получаем

(25.6)
или для элементарного приращения энтропии
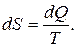
(25.7)
Формула (25.7) верна не только для изотермического процесса, но и для любого равновесного обратимого процесса

(25.8)
Определение энтропии (25.7) было сделано Клаузиусом.
Из выражений (25.2) и (25.6) следует, что энтропия является функцией состояния системы.
Пример 25.1. Определить приращение энтропии 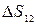 при изотермическом кислороде массой M = 10 г от объема V 1 = 25 л до объема V 2 = 100 л.
при изотермическом кислороде массой M = 10 г от объема V 1 = 25 л до объема V 2 = 100 л.
| Дано: M = 10 г V 1 = 25 л V 2 = 100 л | Решение
 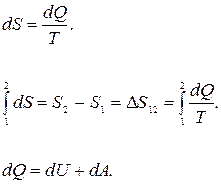
|
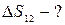
|
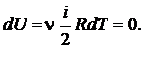

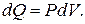
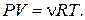
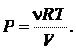
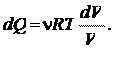
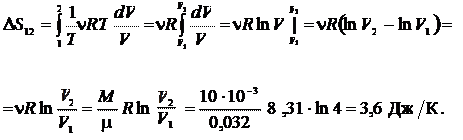
Ответ: 
Пример 25.2. Пять молей гелия изохорически переводят из состояния, в котором его давление 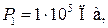 в состояние, в котором его давление
в состояние, в котором его давление 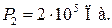 Определить приращение энтропии
Определить приращение энтропии 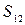 гелия.
гелия.
Дано:
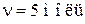
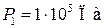
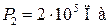
| Решение
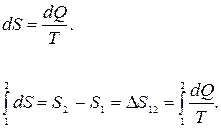
|
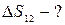
|

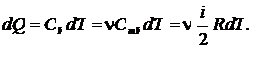

|
|
|
|
|
|
|
|

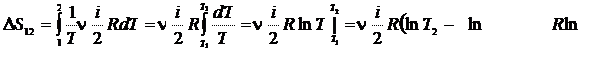

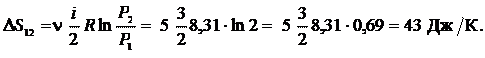
Ответ: 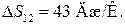
Поиск по сайту: