 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Распределение Максвелла
Назовем состояние газа равновесным,если параметры состояния газа при отсутствии внешних воздействий остаются неизменными во времени.
Пусть газ находится в равновесном состоянии при температуре  . Молекулы газа, непрерывно сталкиваясь между собой, меняют свои скорости как по направлению, так и по величине. Мы не можем сказать, с какой скоростью станет двигаться произвольно выбранная молекула в тот или иной момент времени. В то же самое время мы можем говорить о некотором стационарном (устойчивом) распределении молекул по скоростям: одни молекулы движутся быстро, другие медленно. Но на всякий интервал скоростей, например от 10 до 20 м/с или от 20 до 30 м/с, будет приходиться в среднем (по времени) некоторое определенное число молекул. При отсутствии внешних воздействий установившееся при данной температуре распределение молекул по скоростям в дальнейшем не изменяется.
. Молекулы газа, непрерывно сталкиваясь между собой, меняют свои скорости как по направлению, так и по величине. Мы не можем сказать, с какой скоростью станет двигаться произвольно выбранная молекула в тот или иной момент времени. В то же самое время мы можем говорить о некотором стационарном (устойчивом) распределении молекул по скоростям: одни молекулы движутся быстро, другие медленно. Но на всякий интервал скоростей, например от 10 до 20 м/с или от 20 до 30 м/с, будет приходиться в среднем (по времени) некоторое определенное число молекул. При отсутствии внешних воздействий установившееся при данной температуре распределение молекул по скоростям в дальнейшем не изменяется.
Определим вероятность того, что модуль скорости молекулы лежит между v и v + dv. Пусть 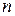 — общее число молекул в единице объема газа, а
— общее число молекул в единице объема газа, а  — число молекул в единице объема газа, скорости которых лежат между v и v + dv. Тогда искомая вероятность
— число молекул в единице объема газа, скорости которых лежат между v и v + dv. Тогда искомая вероятность
 |
(17.1)
Введем величину
 |
(17.2)
— плотность вероятности, которая является функцией модуля скорости молекулы, в связи с чем ее называют функцией распределения вероятности молекул по скорости или просто функцией распределения молекул по скоростям.
Комбинируя формулы (17.1) и (17.2), получаем
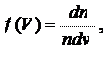 |
(17.3)
откуда
 (17.4)
(17.4)
Зная вид функции f (v), можно, интегрируя выражение (17.4), определить количество молекул в единице объема газа, скорости которых лежат в любом интервале скоростей.
Максвелл теоретически получил вид функции распределения молекул по скоростям:
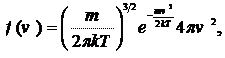 |
(17.5)
где  и
и  — масса молекулы и температура газа;
— масса молекулы и температура газа; 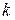 — постоянная Больцмана.
— постоянная Больцмана.

|
Изобразим график функции (17.5) (рис. 17.1).
Рис. 17.1
Из графика видно, что вероятность обнаружения в газе молекулы со скоростью, лежащей в интервале от v 1 до v 2 (см. формулу (17.2))
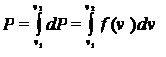
равна заштрихованной площади под кривой f (v).
Вероятность обнаружения в газе молекул с любой скоростью от 0 до 
 |
(17.6)
т. е. площадь под всей кривой f (v) равна единице. Выражение (17.6) называют условием нормировки вероятности.
Скорость, соответствующая максимуму функции распределения f (v), будет наиболее вероятной v вер скоростью молекул. Найдем эту скорость.
Для  очевидно
очевидно

Продифференцируем выражение (17.5) по v и приравняем к нулю.

При v = 0 и v = ∞ функция f (v) минимальна. Следовательно, эти значения отбрасываем. Остается

откуда

Откуда получаем
 |
(17.7)
Используя функцию распределения (17.5), можно найти среднюю  и среднюю квадратичную v кв скорости молекул:
и среднюю квадратичную v кв скорости молекул:
 |
(17.8)
 (17.9)
(17.9)
Поиск по сайту: